Một oxit của lưu huỳnh có thành phần phần trăm của lưu huỳnh là 50% và oxi là 50%. Biết oxit này có khối lượng mol phân tử là 64g/mol. Hãy tìm công thức hoá học của oxit đó.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) PTHH:
2NaHCO3 \(\underrightarrow{t^o}\)Na2CO3+H2O+CO2
b) Áp dụng định luật bảo toàn khối lượng:
mNaHCO3=mNa2CO3+mH2O+mCO2
c) => mCO2=mNaHCO3-(mNa2CO3+mH2O)=84-(53+9)=22 (g)

a. 3Fe + 2O2 \(\underrightarrow{t^o}\) Fe3O4
b. CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
c. CaCO3 + 2HCl → CaCl2 + CO2 + H2O
d. 2K + 2H2O → 2KOH + H2

Gọi hóa trị của M là n
\(n_{H_2}=\dfrac{0,2479}{24,79}=0,01\left(mol\right);n_{M\left(OH\right)_n}=0,5.0,04=0,02\left(mol\right)\)
PTHH: \(2M+2nH_2O\rightarrow2M\left(OH\right)_n+nH_2\)
\(\dfrac{0,02}{n}\)<--------------\(\dfrac{0,02}{n}\)<--------0,01
\(M_2O_n+nH_2O\rightarrow2M\left(OH\right)_n\)
Theo PTHH: \(n_{M\left(OH\right)_n}=2n_{M_2O_n}+n_M\)
=> \(n_{M_2O_n}=\dfrac{0,02-\dfrac{0,02}{n}}{2}=0,01-\dfrac{0,01}{n}\left(mol\right)\)
=> \(\dfrac{0,01}{n}< 0,01\Leftrightarrow n>1\)
Do M là kim loại tan trong nước nên n = 2
=> \(n_M=\dfrac{0,02}{2}=0,01\left(mol\right)\)
\(\xrightarrow[]{\text{BTNT M}}n_{MO}=n_{M\left(OH\right)_2}-n_M=0,02-0,01=0,01\left(mol\right)\)
=> \(0,01.\left(M_M+16\right)+0,01.M_M=2,9\)
=> \(M_M=137\left(g/mol\right)\)
=> M là Barium (Ba)
M : x mol ; M2On : y mol
⇒ n M(OH)n = x + 2y = 0,02
+) n = 1 (KL kiềm ) ⇒ x = 0,02 ; y = 0 ⇒ loại
+) n = 2 (KL kiềm thổ) ⇒ x = 0,01 , y = 0,005
⇒ mhh = 0,01.M + 0,005.(2M + 16.2) = 2,9
⇒ M = Ba

a. Công thức Lewis của CO2: 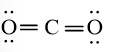
Công thức cấu tạo của CO2 là: O = C = O.
Công thức Lewis của NH3 là: 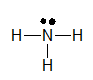
Công thức cấu tạo của NH3 là: \(H-N-H\)
\(|\)
H
b. Hợp chất tan trong nước: CO2 và NH3
Trong chứa hai liên kết cộng hóa trị phân cực (đều phân cực về phía ). Tuy nhiên, có cấu trúc phân tử thẳng () → 2 vectơ mô men cực cùng phương, ngược hướng triệt tiêu nhau → Phân tử không phân cực nên có tan trong nước song là ít tan
+ NH3 tan tốt trong nước vì NH3 có liên kết cộng hóa trị phân cực trong phân tử

a, Y có số hiệu nguyên tử là 8 => Y là oxi
=> cấu hình electron là: \(1s^22s^22p^4\)
X có số hiệu nguyên tử là 11 => X là natri
=> cấu hình electron là: \(1s^22s^22p^63s^1\)
b.O + 2e → O2-
2Na \(\rightarrow\) 2Na\(^{1+}\)+2e
=> \(2Na^{1+}+O^{-2}\rightarrow Na_2O\)




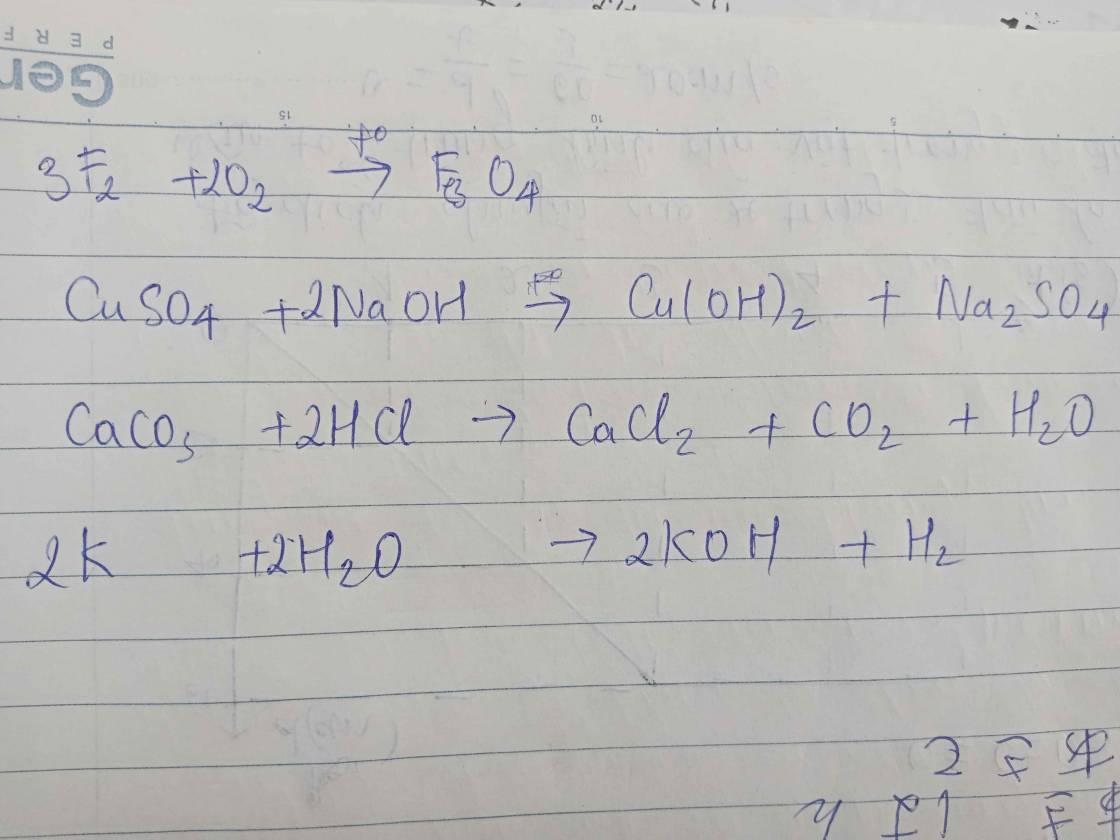
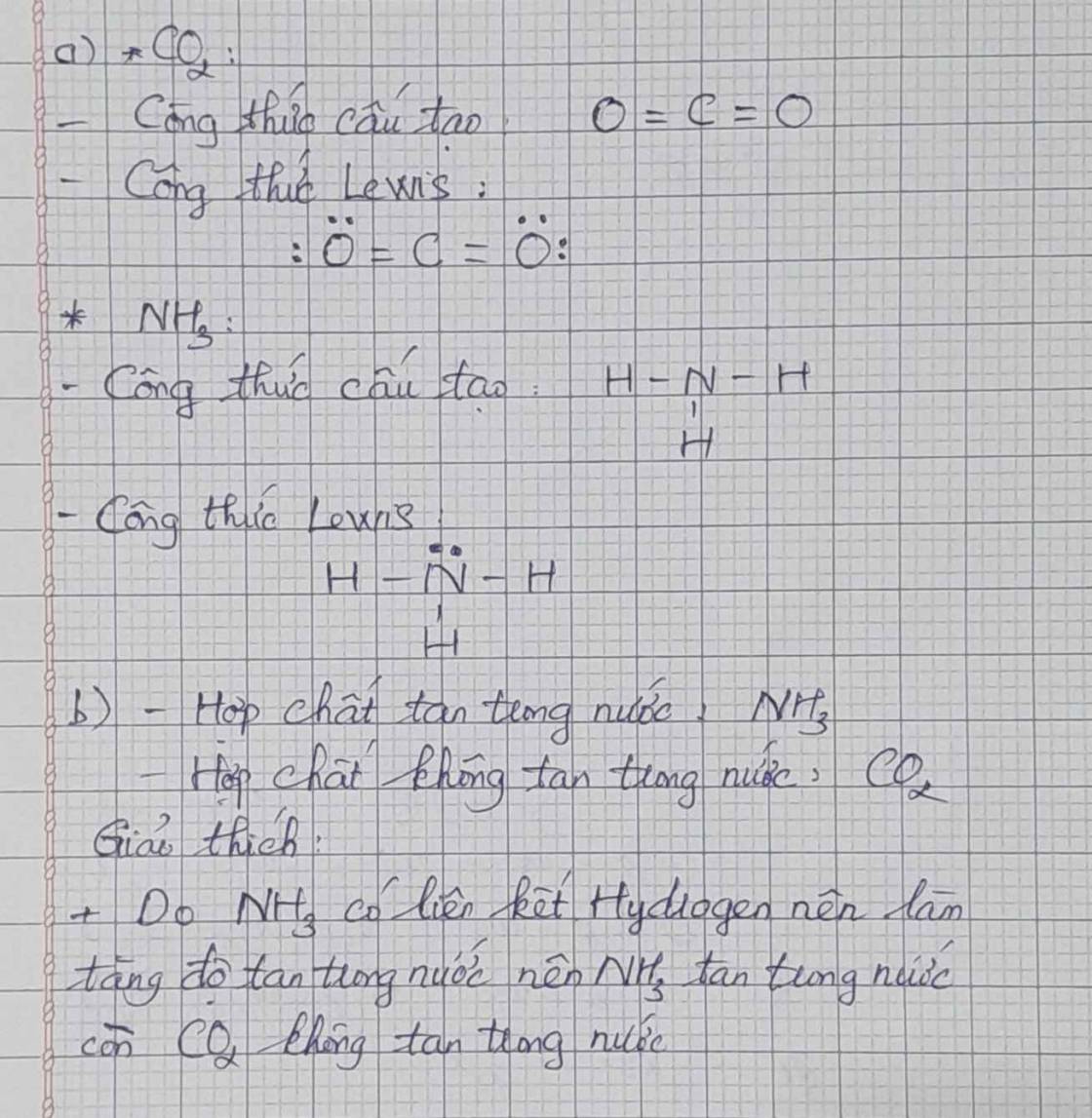
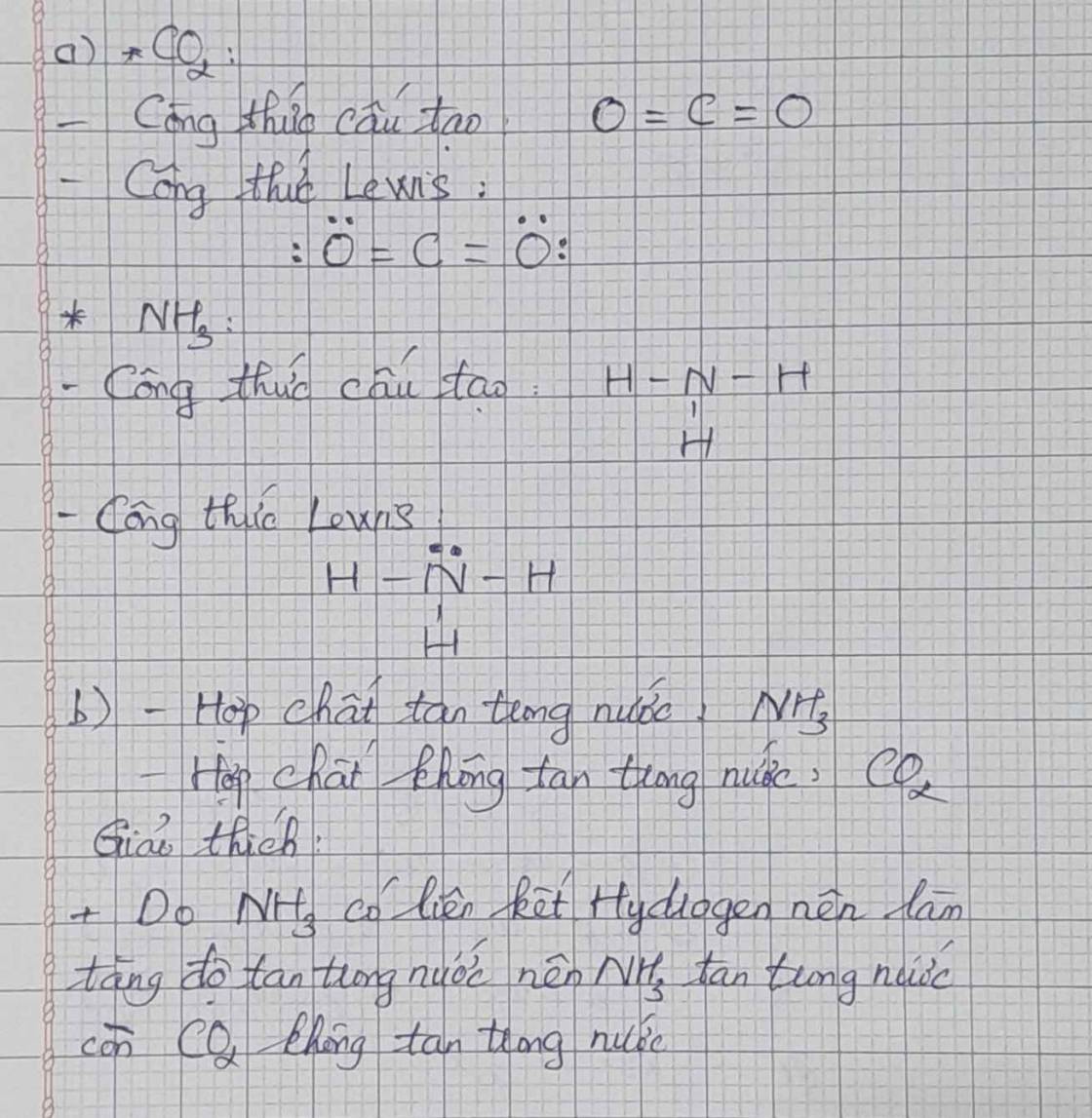
Ta có:
\(m_S=64.50\%=32g\)
\(m_O=64.50\%=32g\)
=> \(n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(n_O=\dfrac{32}{16}=2\left(mol\right)\)
Vậy CTHH của oxit đó là \(SO_2\)