Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Cân bằng trong dung dịch nước SVIP
I. Sự điện li, chất điện li, chất không điện li
1. Hiện tượng điện li
Thí nghiệm thử tính dẫn điện của nước, dung dịch muối ăn và dung dịch đường ăn được thực hiện như hình dưới đây:
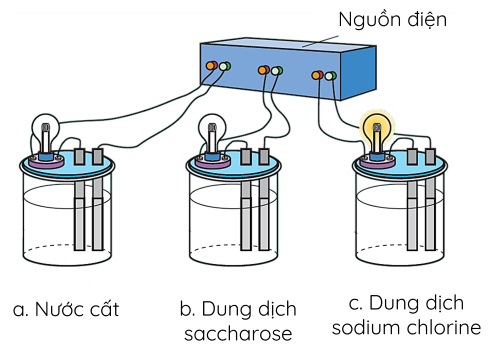
H2O là phân tử có cực, khi cho tinh thể NaCl vào nước sẽ xảy ra quá trình tương tác làm cho các ion Na+ và Cl- tách dần ra khỏi tinh thể và hòa tan vào nước. Quá trình này gọi là quá trình điện li (sự điện li), NaCl gọi là chất điện li, dung dịch dẫn điện thu được gọi là dung dịch chất điện li.
- Quá trình phân li các chất trong nước tạo thành ion được gọi là sự điện li. Những chất khi tan trong nước phân li ra các ion được gọi là chất điện li.
2. Phân loại các chất điện li
Phương trình điện li của HCl trong nước:
\(HCl\rightarrow H^++Cl^-\)
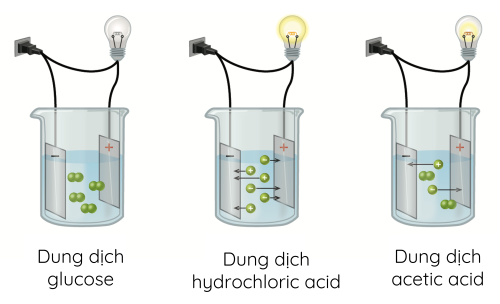
- Chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân li ra ion (dùng một mũi tên chỉ chiều của quá trình điện li).
Các chất điện li mạnh thường gặp là các acid mạnh (HCl, HNO3, H2SO4,...), các base mạnh (NaOH, KOH, Ca(OH)2, Ba(OH)2,...) và hầu hết các muối.
Phương trình điện li của CH3COOH trong nước:
\(CH_3COOH⇌CH_3COO^-+H^+\)
- Chất điện li yếu là chất khi tan trong nước chỉ có một số phân tử chất tan phân li ra ion, phần còn lại vẫn tồn tại ở dạng phân tử trong dung dịch (dùng hai nửa mũi tên ngược chiều nhau). Những chất điện li yếu gồm các acid yếu như CH3COOH, HClO, HF, H2CO3,... và base yếu như Cu(OH)2, Fe(OH)2,...
II. Thuyết Bronsted - Lowry về acid - base
Thuyết Brosted - Lowry cho rằng acid là chất cho proton (H+) và base là chất nhận proton. Acid và base có thể là phân tử hoặc ion.
Ví dụ 1: HCl + H2O → H3O+ + Cl-
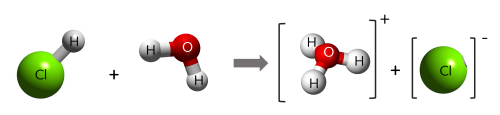
Trong phản ứng trên, HCl cho H+, HCl là acid; H2O nhận H+, H2O là base.
Ví dụ 2: NH3 + H2O ⇌ NH4+ + OH-
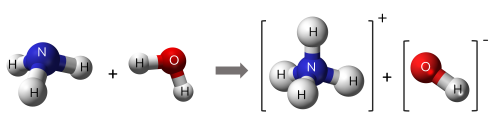
Trong phản ứng thuận, NH3 nhận H+ của H2O, NH3 là base, H2O là acid. Trong phản ứng nghịch, ion NH4+ là acid, ion OH- là base.
Phân tử H2O vừa có thể nhận H+, vừa có thể cho H+, nên H2O là chất lưỡng tính.
III. Khái niệm pH. Chất chỉ thị acid - base
1. Khái niệm pH
Nước là chất điện li yếu: \(H_2O⇌H^++OH^-\)
Tích nồng độ ion H+ và OH- trong nước nguyên chất hoặc trong dung dịch nước có nồng độ chất tan không quá cao ở mỗi nhiệt độ là một hằng số, gọi là tích số ion của nước (Kw):
Kw = [H+][OH-]
Ở 25oC, Kw = [H+][OH-] = 10-14.
Nước có môi trường trung tính, tức là [H+] = [OH-]=10-7 M.
Khi thêm acid vào nước, nồng độ H+ tăng lên, nồng độ OH- giảm đi. Vì vậy [H+] > [OH-] nên [H+] > 10-7 mol/L hay pH < 7.
Khi thêm base vào nước, nồng độ OH- tăng lên, nồng độ H+ giảm đi. Vì vậy [H+] < [OH-] nên [H+] < 10-7 mol/L hay pH > 7.
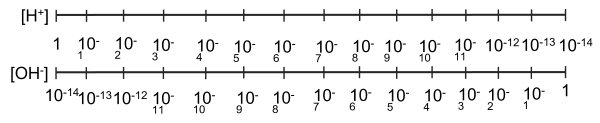
Dộ acid và độ kiềm của dung dịch có thể được đánh giá bằng nồng độ H+ hoặc quy về giá trị pH với quy ước sau:
pH = -lg[H+] hoặc [H+] = 10-pH
2. Ý nghĩa của pH trong thực tiễn
Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khỏe con người, sự phát triển của động vật, thực vật,...
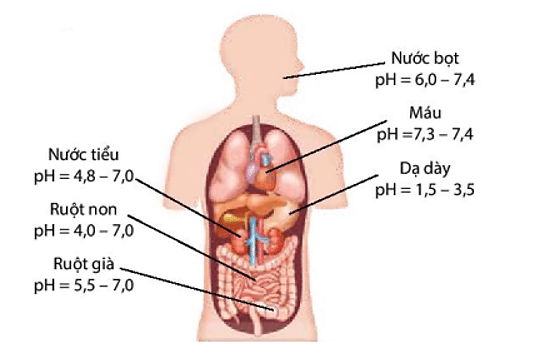
Trong cơ thể của người, máu và các dịch của dạ dày, mật,... đều có giá trị pH trong một khoảng nhất định. Chỉ số pH trong cơ thể liên quan đến tình trạng sức khoẻ. Do đó, mỗi người cần duy trì được chế độ ăn để cơ thể có pH phù hợp.
Độ pH trong đất được dùng làm cơ sở cho việc sử dụng đất, sử dụng phân bón hợp lí và hiệu quả nhằm bảo vệ chất lượng đất và tránh ô nhiễm nguồn nước.
Ngưỡng giới hạn cho phép đối với độ pH của nước trong khoảng 6 - 8,5.
3. Chất chỉ thị acid - base
Giá trị pH của dung dịch được xác định gần đúng bằng cách sử dụng chất chỉ thị acid - base. Khi cần xác định giá trị pH chính xác hơn, người ta sử dụng máy đo pH.
IV. Chuẩn độ acid - base
Nguyên tắc: Chuẩn độ acid - base là phương pháp được sử dụng để xác định nồng độ dung dịch acid hoặc base bằng dung dịch base hoặc dung dịch acid đã biết chính xác nồng độ.
Khi chuẩn độ, người ta thêm từ từ dung dịch đựng trong burette vào dung dịch đựng trong bình tam giác. Thời điểm mà hai chất tác dụng vừa đủ gọi là điểm tương đương. Điểm tương đương được xác định bằng sự đổi màu của chất chỉ thị acid - base.
Thao tác khi chuẩn độ: Tay thuận cầm bình tam giác, lắc nhẹ dung dịch trong bình, tay không thuận điều khiển khóa burette để thêm từ từ từng giọt dung dịch trên burette vào bình tam giác.
Thí nghiệm: Chuẩn độ dung dịch base mạnh bằng dung dịch chuẩn acid mạnh
Chuẩn bị:
- Hóa chất: dung dịch HCl 0,1 M; dung dịch NaOH cần xác định nồng độ; dung dịch phenolphthalein.
- Dụng cụ: pipette 10 mL; burette 25 mL; bình tam giác 100 mL; bình tia nước cất, giá đỡ, kẹp burette.
Tiến hành:
Bước 1: Tráng sạch burette bằng nước cất, sau đó tráng lại bằng dung dịch NaOH. Lắp dụng cụ như hình, xoay vạch đọc thể tích về phía trước mắt. Cho dung dịch NaOH vào cốc thủy tinh, sau đó rót vào burette đã khóa và chỉnh về vạch 0.
Bước 2: Dùng pipette lấy 10 mL dung dịch HCl 0,1 M cho vào bình tam giác, thêm 1 - 2 giọt phenolphthalein.
Bước 3: Mở khoá burette, nhỏ từng giọt dung dịch NaOH xuống bình tam giác (lắc đều trong quá trình chuẩn độ) đến khi dung dịch xuất hiện màu hồng nhạt (bền trong khoảng 30 giây) thì dừng chuẩn độ.
Bước 4: Đọc thể tích dung dịch NaOH đã dùng.
Bước 5: Lặp lại ít nhất 3 lần. Lấy giá trị trung bình của 3 lần chuẩn độ.
Nồng độ mol của dung dịch NaOH được tính theo công thức:
\(C_{NaOH}=\dfrac{V_{HCl}.C_{HCl}}{V_{NaOH}}\)

V. Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+ và CO32-
1. Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion Al3+, Fe3+
Phèn chua hay phèn nhôm - kali (K2SO4.Al2(SO4)3.24H2O) và phèn sắt ((NH4)2SO4.Fe2(SO4)3.24H2O) được sử dụng làm chất keo tụ trong quá trình xử lý nước do tạo Al(OH)3, Fe(OH)3. Các hydroxide này ở dạng keo, kéo theo các chất bẩn lơ lửng trong nước lắng xuống.
Phương trình thủy phân đơn giản:
\(M^{3+}+3H_2O⇌M\left(OH\right)_3\downarrow+3H^+\)
2. Ý nghĩa thực tiễn cân bằng trong dung dịch nước của ion CO32-
Hồ bơi tiêu chuẩn có độ pH nước khoảng từ 7,2 đến 7,8. Mất cân bằng pH là một trong những vấn đề thường gặp nhiều ở hồ bơi. Có thể sử dụng Soda (Na2CO3) làm hóa chất để tăng pH của nước hồ bơi.
Phương trình thủy phân ion CO32- được biểu diễn đơn giản như sau:
CO32- + H2O ⇌ HCO3- + OH-
1. Quá trình phân li các chất trong nước tạo thành các ion được gọi là sự điện li.
2. Chất khi tan trong nước phân li hoàn toàn thành các ion là chất điện li mạnh.
3. Chất điện li yếu là chất khi tan trong nước chỉ có một số phân tử hòa tan phân li thành ion, phân còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
4. Chất không điện li là chất khi hòa tan vào trong nước, các phân tử không phân li thành ion.
5. Thuyết Bronsted - Lowry về acid - base: acid là chất cho proton (H+) và base là chất nhận proton.
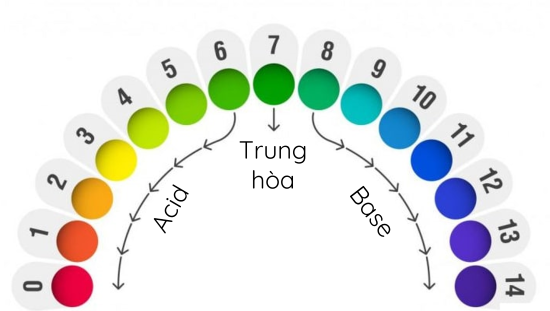
6. pH là chỉ số đánh giá độ acid hay độ base của một dung dịch. Thang pH thường dùng có giá trị từ 1 đến 14.
7. Chất chỉ thị acid - base là chất có màu sắc biến đổi phụ thuộc vào giá trị pH của dung dịch.
8. Trong phương pháp chuẩn độ acid - base, người ta dùng dung dịch acid hoặc dung dịch base đã biết chính xác nồng độ làm dung dịch chuẩn để xác định nồng độ dung dịch base hoặc dung dịch acid chưa biết nồng độ.
9. Ion Al3+, Fe3+ dễ bị thủy phân trong nước tạo thành base không tan và cho môi trường acid. Ion CO32- bị thủy phân trong môi trường base.

Bạn có thể đánh giá bài học này ở đây