Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Biến thiên enthalpy trong các phản ứng hoá học SVIP
I. PHẢN ỨNG TOẢ NHIỆT, PHẢN ỨNG THU NHIỆT
- Khi các phản ứng hoá học xảy ra thường có sự trao đổi nhiệt với môi trường, làm thay đổi nhiệt độ môi trường.
- Phản ứng toả nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
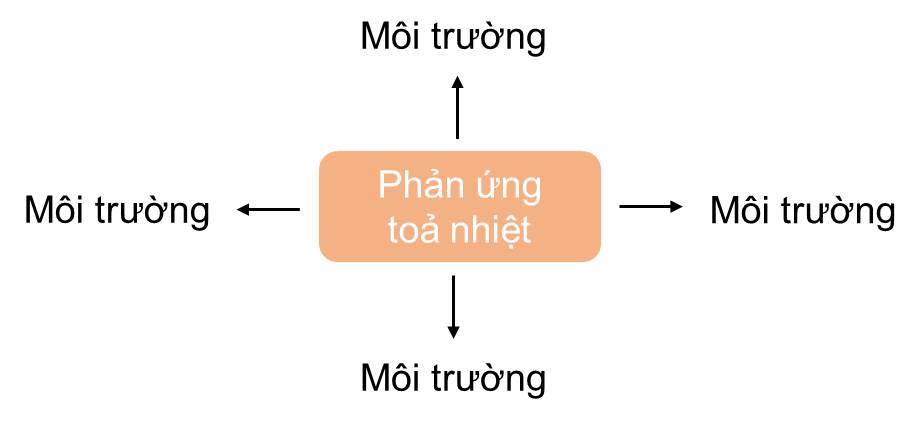
- Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
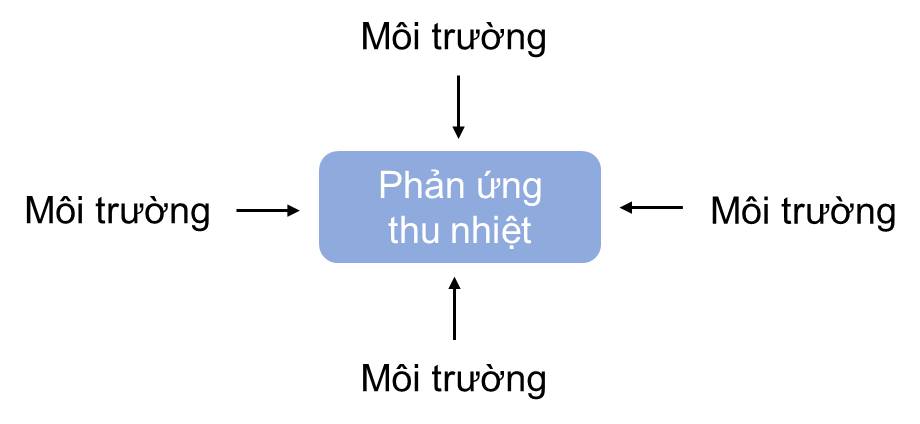
II. BIẾN THIÊN ENTHALPY CỦA PHẢN ỨNG
1. Biến thiên enthalpy
Nhiệt lượng toả ra hay thu vào của phản ứng ở điều kiện áp suất không đổi gọi là biến thiên enthalpy của phản ứng (hay nhiệt phản ứng).
- Kí hiệu: \(\mathrm{\Delta}_{r}\)H (r là viết tắt của từ tiếng Anh reaction, nghĩa là phản ứng).
- Phương trình hoá học kèm theo trạng thái của các chất và giá trị \(\mathrm{\Delta}_{r}\)H gọi là phương trình nhiệt hoá học.
2. Biến thiên enthalpy chuẩn
- Biến thiên enthalpy của các phản ứng phụ thuộc vào điều kiện xảy ra phản ứng (như nhiệt độ, áp suất) và trạng thái vật lí của chất.
- Muốn so sánh biến thiên enthalpy của các phản ứng khác nhau thì cần xác định chúng ở cùng một điều kiện.
- Biến thiên enthalpy chuẩn là nhiệt toả ra hay thu vào của một phản ứng được xác định ở điều kiện chuẩn:
+ Áp suất 1 bar (đối với chất khí)
+ Nồng độ 1 mol/L (đối với chất tan trong dung dịch)
+ Nhiệt độ thường được chọn là 25\(℃\) (298K).
- Kí hiệu: \(\mathrm{\Delta}_{r}H_{298}^{{^\circ}}\)
3. Ý nghĩa của biến thiên enthalpy
- Dấu của biến thiên enthalpy cho biết một phản ứng là toả nhiệt hay thu nhiệt.
\(\mathrm{\Delta}_{r}\)H > 0: Phản ứng thu nhiệt
\(\mathrm{\Delta}_{r}\)H < 0: Phản ứng toả nhiệt
- Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng toả ra hay thu vào của phản ứng càng nhiều.
- Các phản ứng xảy ra ở nhiệt độ phòng thường là phản ứng toả nhiệt, các phản ứng thu nhiệt thường xảy ra khi đun nóng.
III. TÍNH BIẾN THIÊN ENTHALPY THEO NHIỆT TẠO THÀNH
1. Khái niệm nhiệt tạo thành
Nhiệt tạo thành của một chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền vững nhất, ở một điều kiện xác định.
Kí hiệu: \(\mathrm{\Delta}_{f}\)H
*Nhiệt tạo thành chuẩn: Là nhiệt tạo thành ở điều kiện chuẩn.
Kí hiệu: \(\mathrm{\Delta}_{f}H_{298}^{{^\circ}}\)
- Nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng 0.
VD: \(\mathrm{\Delta}_{f}H_{298}^{{^\circ}}\)((O2)(g)) = 0 kJ/mol.
\(\mathrm{\Delta}_{f}H_{298}^{{^\circ}}\)((H2)(g)) = 0 kJ/mol.
2. Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành
Biến thiên enthalpy của phản ứng được xác định bằng hiệu số giữa tổng nhiệt tạo thành các chất sản phẩm (sp) và tổng nhiệt tạo thành của các chất đầu (cđ), có tính đến cả hệ số của các chất trong phương trình hoá học.
\(\mathrm{\Delta}_{r}H_{298}^{{^\circ}}\) = \(\sum_{}^{}{\mathrm{\Delta}_{f}H_{298}^{{^\circ}}\ \left( sp \right)} - \ \sum_{}^{}{\mathrm{\Delta}_{f}H_{298}^{{^\circ}}\ (cđ)}\)
IV. TÍNH BIÊN THIÊN ENTHALPY THEO NĂNG LƯỢNG LIÊN KẾT
- Phản ứng hoá học là quá trình phá vỡ liên kết trong chất đầu và hình thành các liên kết mới để tạo thành sản phẩm. Sự phá vỡ liên kết cần cung cấp năng lượng, còn sự hình thành liên kết lại giải phóng năng lượng.
Biến thiên enthalpy của phản ứng (mà các chất đều ở thể khí), bằng hiệu số giữa tổng năng lượng liên kết chất đầu và tổng năng lượng liên kết của các sản phẩm (ở cùng điều kiện nhiệt độ và áp suất).
\(\mathrm{\Delta}_{r}H_{298}^{{^\circ}}\) = \({\sum_{}^{}E}_{b}(cđ) - \ \sum_{}^{}{E_{b}\left( sp \right)}\)
Các em đã học:
1. Phản ứng toả nhiệt là phản ứng khi xảy ra kèm theo sự truyền nhiệt từ chất và phản ứng ra môi trường.
2. Phản ứng thu nhiệt là phản ứng khi xảy ra kèm theo sự truyền nhiệt từ môi trường vào chất phản ứng.
3. Biến thiên enthalpy của phản ứng là nhiệt lượng toả ra hay thu vào của phản ứng ở một điều kiện xác định.
4. Biểu thức tính biến thiên enthalpy của các phản ứng ở điều kiện chuẩn:
- Theo nhiệt tạo thành
\(\mathrm{\Delta}_{r}H_{298}^{{^\circ}}\) = \(\sum_{}^{}{\mathrm{\Delta}_{f}H_{298}^{{^\circ}}\ \left( sp \right)} - \ \sum_{}^{}{\mathrm{\Delta}_{f}H_{298}^{{^\circ}}\ (cđ)}\)
- Theo năng lượng liên kết (các chất đều ở thể khí)
\(\mathrm{\Delta}_{r}H_{298}^{{^\circ}}\) = \({\sum_{}^{}E}_{b}(cđ) - \ \sum_{}^{}{E_{b}\left( sp \right)}\)

Bạn có thể đánh giá bài học này ở đây