Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
Ở các lớp dưới và kiến thức từ bài học đã học cũng như trong đời sống, các em biết gì
về nguyên tố oxi , đơn chất oxi? Màu sắc , mùi vị, tính tan trong nước của khí oxi?
Oxi có thể tác dụng với các chất khác không? Nếu có thì tác dụng mạnh hay yếu ?
Để trả lời những câu hỏi này chúng ta hãy cũng vào bài học ngày hôm nay:
Tính chất của Oxi.
I. Kiến thức chung
- Kí hiệu hóa học của của oxi: O
- Công thức hóa học của đơn chất khí oxi: O2
- Nguyên tử khối: 16
- Phân tử khối: 32
- Oxi rất phổ biến, chúng là nguyên tố phổ biến nhất trên trái đất (chiếm gần một nửa khối lượng vỏ trái đất). Ở dạng đơn chất oxi chủ yếu có trong không khí. Ở dạng hợp chất oxi phổ biến hơn, chúng có ở trong nước, đường, quặng, đất đá, cơ thể con người, động vật và thực vật.

II. TÍNH CHẤT VẬT LÍ
Khí oxi là khí không màu, không mùi, ít tan trong nước, nặng hơn không khí. Oxi hóa lỏng ở -183 độ C. Oxi lỏng có màu xanh nhạt.

Hình 2: Trạng thái của khí oxi và oxi lỏng.
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với phi kim
a. Tác dụng với lưu huỳnh (S)
Cách tiến hành: Lấy muỗng sắt chứa bột S rồi đun trên ngọn lửa đèn cồn. Sau đó, đưa lưu huỳnh đang cháy vào lọ có chứa oxi (video 1). Các em cùng quan sát hiện tượng và nhận xét.
Video 1: Thí nghiệm đốt cháy lưu huỳnh trong oxi.
Hiện tượng: Lưu huỳnh cháy trong không khí với ngọn lửa nhỏ, màu xanh nhạt. Khi cho vào bình đựng khí oxi thì lưu huỳnh cháy mãnh liệt hơn tạo thành lưu huỳnh đioxit (SO2) gọi là khí sunfurơ và một lượng rất ít (SO3).
Phương trình: Sự cháy trong không khí của lưu huỳnh được biểu diễn bằng phương trình hóa học sau:
S(r) + O2(k) 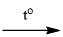 SO2(k)
SO2(k)
b. Tác dụng với photpho (P)
Cách tiến hành: Cho vào muôi sắt một lượng nhỏ photpho đỏ. Đốt cháy photpho đỏ trên ngọn lửa đèn cồn, sau đó đưa muôi sắt có chứa photpho đang cháy vào lọ có oxi. Quan sát hiện tượng.
Video 2: Thí nghiệm đốt cháy Photpho đỏ trong Oxi.
- Hiện tượng: Photpho cháy ngoài không khí cho ngọn lửa sáng yếu, sau khi cho vào lọ có oxi, photpho tiếp tục cháy cho ngọn lửa sáng chói và có khói trắng tạo thành là điphotpho pentaoxit (P2O5).
- Phương trình hóa học: 4P(r) + 5O2 (k)
 2P2O5(r)
2P2O5(r)
2. Tác dụng với kim loại
- Cách tiến hành: Lấy một đoạn dây sắt quấn lò xo xung quanh một mẩu than gỗ (mục đích mẩu than gỗ là cung cấp nhiệt cho dây sắt cháy) rồi đem đốt trên ngọn lửa đèn cồn. Khi thấy dây sắt đỏ, đưa nhanh vào lọ chứa oxi. Quan sát và nhận xét.
Video 3: Thí nghiệm đốt dây sắt trong oxi .
Hiện tượng: Phản ứng xảy ra mãnh liệt, sáng chói, không có lửa, khói, tạo ra các hạt nhỏ nóng đỏ bắn vào thành bình là sắt (II,III) oxit, công thức hóa học là Fe3O4 thường được gọi là sắt từ oxit.
- Phương trình hóa học: 3Fe(r) + 2O2(k)
 Fe3O4(r)
Fe3O4(r)
3. Tác dụng với hợp chất
- Khí metan (có trong bùn, ao, khí biogas) cháy được trong không khí do có phản ứng với oxi, tỏa nhiều nhiệt.
- Phương trình hóa học: CH4(k) + 2O2(k)
 CO2(k) + 2H2O(h)
CO2(k) + 2H2O(h)
IV. TỔNG KẾT
1. Oxi là chất khí, không màu, không mùi, ít tan trong nước, nặng hơn không khí.
2. Khí oxi là một đơn chất phi kim rất hoạt động, đặc biệt là ở nhiệt độ cao, dễ dàng tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất. Trong các hợp chất hóa học, nguyên tố oxi có hóa trị II.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây