Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. CÁCH PHA CHẾ MỘT DUNG DỊCH THEO NỒNG ĐỘ CHO TRƯỚC
Để pha chế một dung dịch, ta thực hiện các bước sau:
| Bước 1 | Bước 2 |
Tính toán các đại lượng cần dùng.
| Pha chế dung dịch theo các đại lượng đã xác định.
|
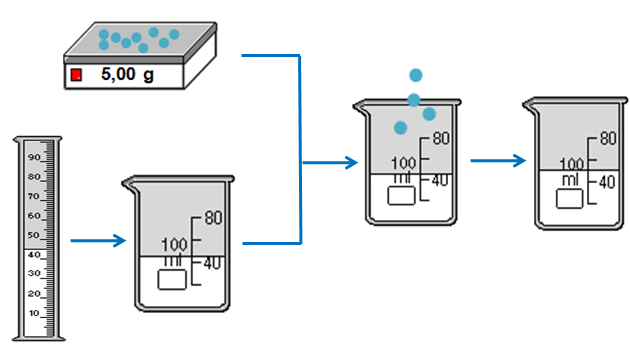
Ví dụ 1:
| Tính toán | Cách pha chế |
mCuSO4 = \(\dfrac{10.50}{100}\) = 5 gam
mdung môi = mdung dịch - mchất tan mdung môi = 50 - 5 = 45 gam. |
|
Quá trình pha chế 50 gam dung dịch CuSO4 10%. | |
Ví dụ 2: Hãy tính toán và pha chế 50 ml dung dịch CuSO4 có nồng độ 1M.
| Tính toán | Cách pha chế |
nCuSO4 = \(\dfrac{50.1}{1000}\) = 0,05 mol
mCuSO4 = 0,05 x 160 = 8 gam |
|
Quá trình pha chế 50 ml dung dịch CuSO4 1M. | |
2. PHA CHẾ DUNG DỊCH MỚI TỪ MỘT DUNG DỊCH CHO SẴN
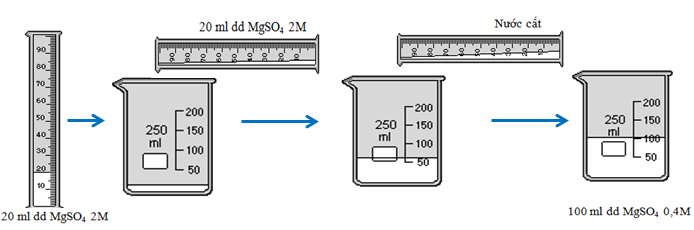
Ví dụ 1: Trình bày phương pháp pha chế 100 ml dung dịch MgSO4 0,4M từ dung dịch MgSO4 2M.
| Tính toán | Cách pha chế |
nMgSO4 = \(\dfrac{0,4.100}{1000}\) = 0,04 mol
Vml = \(\dfrac{1000.0,04}{2}\) = 20 ml |
|
Quá trình pha loãng dung dịch MgSO4 2M. | |
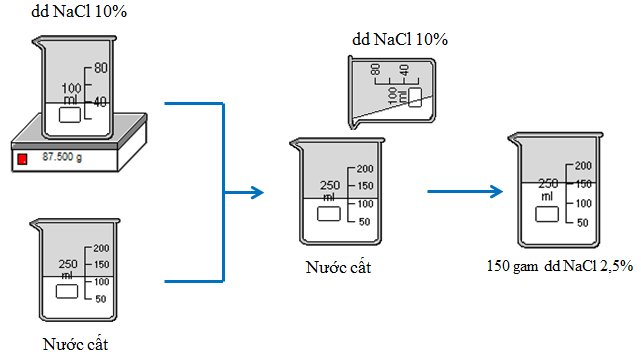
| Tính toán | Cách pha chế |
mNaCl = \(\dfrac{2,5.150}{100}\) = 3,75 g
mdd = \(\dfrac{100.3,75}{10}\) = 37,5 g
mH2O = 150 - 37,5 = 112,5 g |
|
Quá trình pha chế dung dịch NaCl 2,5%. | |
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!


.jpg)
.PNG)
Bạn có thể đánh giá bài học này ở đây