Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
KIẾN THỨC CẦN NHỚ
1. Khí oxi là một đơn chất phi kim có tính oxi hóa mạnh, rất hoạt động, đặc biệt ở nhiệt độ cao, dễ tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất.

2. Oxi là chất khí rất cần cho sự hô hấp của người và động vật, dùng để đốt nhiên liệu trong đời sống và sản xuất.

3. Nguyên liệu thường được dùng để điều chế khí Oxi trong phòng thí nghiệm là các hợp chất giàu oxi như KClO3, KMnO4 và dễ bị phân hủy ở nhiệt đ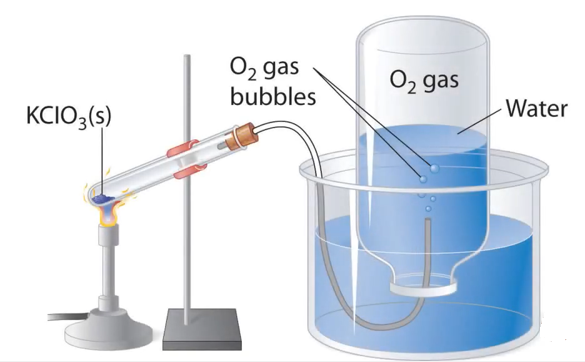 ộ cao.
ộ cao.
2KMnO4 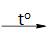 K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
2KClO3 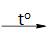 2KCl + 3O2
2KCl + 3O2
Thu khi oxi bằng phương pháp đẩy nước.
4. Sự tác dụng của oxi với chất khác là sự oxi hóa.
Ví dụ:
2Cu + O2 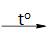 2CuO
2CuO
2C2H6 + 7O2 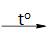 4CO2 + 6H2O
4CO2 + 6H2O
5. Oxit là hợp chất của hai nguyên tố, trong đó có một nguyên tố là oxi. Oxit gồm hai loại chính: oxit axit và oxit bazơ.

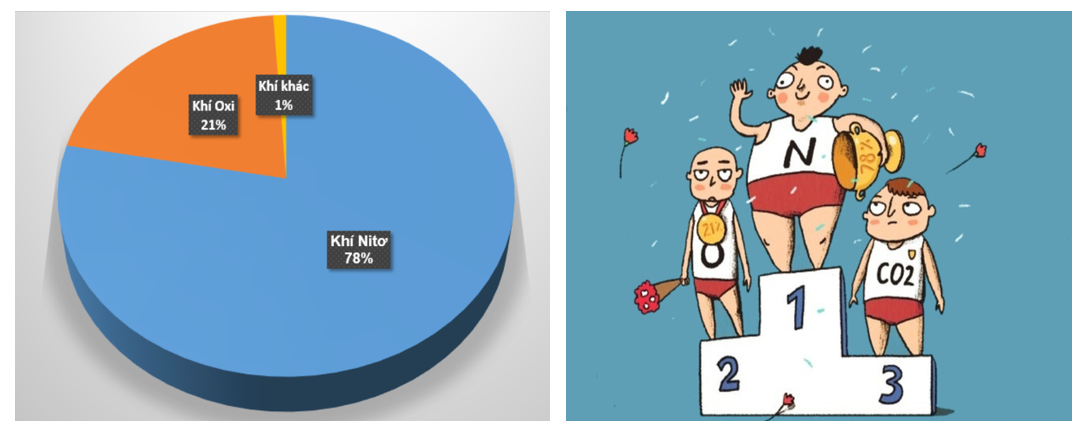
6. Không khí là hỗn hợp của nhiều chất khí. Thành phần theo thể tích của không khí là 78% khí nito ,21% khí Oxi ,1% các khí khác (khí hiếm, CO2, hơi nước,..).
7. Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
Ví dụ:
4P + 5O2 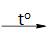 2P2O5
2P2O5
CaO + H2O → Ca(OH)2

8. Phản ứng phân hủy là phản ứng hóa học trong đó một chất mới sinh ra hai hay nhiều chất mới.
Ví dụ:
2KNO3 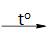 2KNO2 + O2
2KNO2 + O2
2KClO3 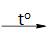 2KCl + 3O2
2KCl + 3O2

Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây