Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ CÁC NGUYÊN TỐ HOÁ HỌC
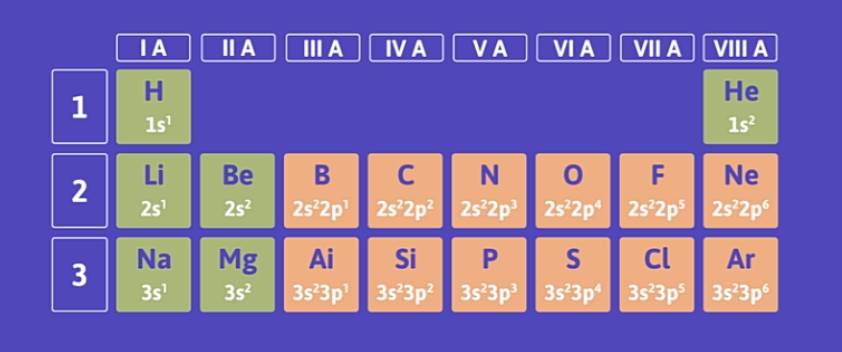
Xét cấu hình electron nguyên tử của các nguyên tố trong ba chu kì đầu ta thấy: Đầu mỗi chu kì là nguyên tố có cấu hình electron lớp ngoài cùng của nguyên tử là ns1. Kết thúc mỗi chu kì là nguyên tố có cấu hình electron lớp ngoài cùng của nguyên tử là ns2np6 (trừ chu kì 1).
Vậy, cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một nhóm A được lặp lại sau mỗi chu kì, ta nói rằng: Chúng biến đổi một cách tuần hoàn.
Sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng chính là nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố.
II.CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ NHÓM A
1. Cấu hình electron ngoài cùng của nguyên tử các nguyên tố nhóm A
a. Các nguyên tố thuộc cùng một nhóm A có cùng số electron lớp ngoài cùng. Chính sự giống nhau này làm cho nguyên tử các nguyên tố trong cùng một nhóm A có tính chất hóa học tương tự nhau.
b. Số thứ tự của nhóm cho biết số electron ở lớp ngoài cùng và đồng thời cũng là số electron hóa trị trong nguyên tử của các nguyên tố đó.
c.
| IA, IIA | IIIA ➞ VIA |
| Electron hóa trị là electron s, các nguyên tố là nguyên tố s. | Electron hóa trị là electron s và p, các nguyên tố là nguyên tố p (trừ He). |
2. Một số nhóm A tiêu biểu
a. Nhóm VIIIA (nhóm khí hiếm)
- Gồm các nguyên tố: heli, neon, agon, kripton, xenon và rađon.
- Cấu hình e lớp ngoài cùng chung: ns2np6 (trừ He). Là cấu hình electron bền vững.
- Vì có cấu hình electron bền vững nên hầu hết các khí hiếm không tham gia phản ứng hoá học (trừ một số điều kiện đặc biệt). Ở điều kiện thường chúng tồn tại ở trạng thái khí và phân tử chỉ gồm một nguyên tử.

b. Nhóm IA (nhóm kim loại kiềm)
- Gồm các nguyên tố: liti, natri, kali, rubiđi, xesi, franxi.

- Cấu hình e lớp ngoài cùng: ns1. Trong các phản ứng hóa học, nguyên tử các nguyên tố kim loại kiềm có xu hướng nhường đi 1 electron để đạt được cấu hình electron bền vững của khí hiếm. Do đó, trong các hợp chất, các nguyên tố kim loại kiềm chỉ có hóa trị 1.
- Các kim loại kiềm là các kim loại điển hình, thường có các phản ứng hóa học sau:
Tác dụng mạnh với oxi tạo thành các oxit tan trong nước như Li2O, Na2O, K2O...
4K + O2 \(\underrightarrow{t^o}\) 2K2O
Tác dụng mạnh với nước ở nhiệt độ thường tạo thành hidro và hidroxit tương ứng như NaOH, KOH...
2Na + 2H2O → 2NaOH + H2
Tác dụng với các phi kim khác tạo thành muối như NaCl, KCl...
c. Nhóm VIIA (nhóm halogen)
- Gồm các nguyên tố: flo, clo, brom, iot, atatin.
- Cấu hình electron lớp ngoài cùng: ns2np5. Trong các phản ứng hóa học, nguyên tử halogen có xu hướng nhận thêm 1 electron để đạt được cấu hình electron bền vững của khí hiếm. Do đó, trong các hợp chất, các nguyên tố halogen chỉ có hóa trị 1.
- Ở dạng đơn chất, các phân tử halogen chỉ gồm hai nguyên tử: F2, Cl2, Br2, I2.
- Nhóm halogen gồm các phi kim điển hình có những tính chất hóa học sau:
Tác dụng với kim loại tạo thành các muối như: KBr, FeCl3...
Tác dụng với hidro tạo thành những hợp chất khí: HF, HCl, HBr, HI. Trong nước chúng tan thành các dung dịch axit tương ứng.
.gif)
Hidroxit của các halogen là những axit: HClO, HClO3...
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây