Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
A. KIẾN THỨC CẦN NẮM
1. Nguyên tử được tạo bởi electron và hạt nhân. Hạt nhân được tạo nên bởi proton và nơtron
| Đặc tính hạt | Vỏ nguyên tử | Hạt nhân | |
| electron (e) | proton (p) | notron (n) | |
| Điện tích (q) | qe = -1,602.10-19C = 1- | qp = 1,602.10-19C = 1+ | qn = 0 |
| Khối lượng (m) | me = 9,1094.10-31 kg = 0,00055u | mp = 1,6726.10-27 kg = 1u | mn = 1,6748.10-27 kg = 1u |
2. Trong nguyên tử, số đơn vị điện tích hạt nhân Z = số proton = số electron
- Số khối A = Z + N
- Nguyên tử khối coi như bằng tổng số các proton và các nơtron (gần đúng).
- Nguyên tử khối của một nguyên tố có nhiều đồng vị là nguyên tử khối trung bình của các đồng vị đó.
- Nguyên tố hóa học là những nguyên tử có cùng số Z.
- Các đồng vị của một nguyên tố hóa học là các nguyên tử có cùng số Z, khác số N.

3. Số hiệu nguyên tử Z và số khối A đặc trưng cho nguyên tử
Số đơn vị điện tích hạt nhân và số khối được coi là những đặc trưng cơ bản của nguyên tử. Để kí hiệu nguyên tử, người ta đặt kí hiệu các chỉ số đặc trưng ở bên trái kí hiệu nguyên tố X với số khối A ở trên và số hiệu nguyên tử Z ở dưới: \(^A_ZX\).
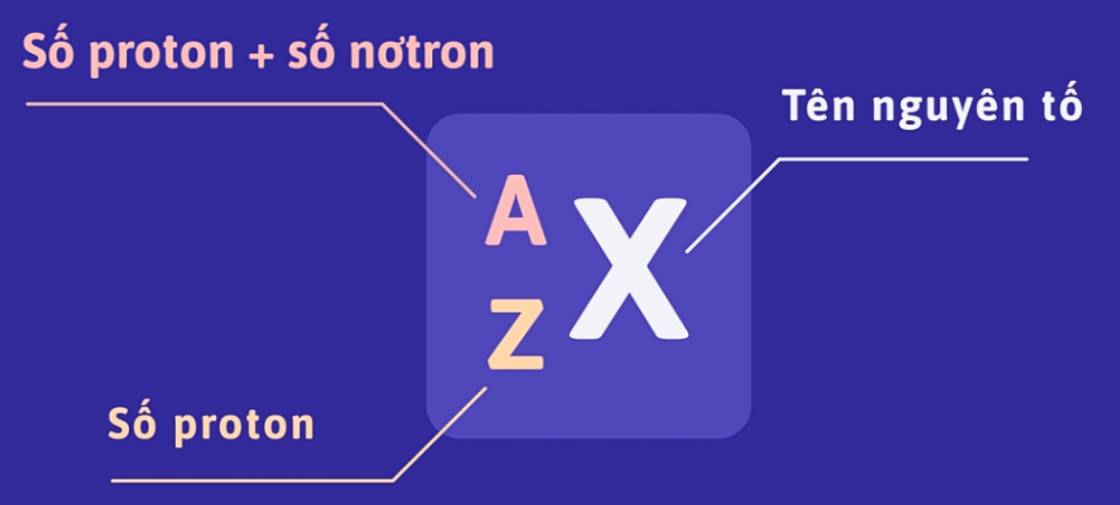
AZX
Số khối (kí hiệu là A) là tổng số hạt proton (kí hiệu Z) và tổng số hạt nơtron (kí hiệu N) của hạt nhân đó.

B. BÀI TẬP
Bài 1. Một nguyên tử X có tổng số hạt là 62 và có số khối A < 43. Tìm số proton, nơtron và khối lượng mol nguyên tử của X.
Lời giải
Tổng số hạt của X là S = P + N + E = 2Z + N = 62
=> N = 62 - 2Z
Ta có Z ≤ N < 1,52Z => Z ≤ 62 - 2Z < 1,52Z
<=> 17,58 < Z < 20,67
Vì Z là số nguyên dương nên Z chỉ có thể có các giá trị: 18, 19, 20.
| Z | 18 | 19 | 20 |
| N | 26 | 24 | 22 |
| A | 44 | 43 | 42 |
Vì A < 43 nên giá trị của A thỏa mãn là 42 => N = 22 và Z = 20.
Bài 2. Tổng số hạt trong nguyên tử R là 76, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 20. Tìm số hạt p, n, e.
Lời giải
Ta có \(\left\{{}\begin{matrix}P+N+E=76\\P+E-N=20\end{matrix}\right.\) mà P = E ↔ \(\left\{{}\begin{matrix}2P+N=76\\2P-N=20\end{matrix}\right.\) ↔ \(\left\{{}\begin{matrix}P=24\\N=28\end{matrix}\right.\)
Vậy R có 24 hạt proton, 24 hạt electron và 28 hạt nơtron.
Bài 3. Khối lượng nguyên tử của brom là 79,91. Brom có hai đồng vị, đồng vị thứ nhất là 79Br chiếm 54,5%. Tìm khối lượng nguyên tử của đồng vị thứ hai.
Lời giải
Phần trăm đồng vị thứ hai của brom là: 100 - 54,5 = 45,5%.
Áp dụng công thức \(\overline{A}=\frac{aX+bY}{100}\) = \(\dfrac{79,91.54,5+45,5.Y}{100}\) = 79,91
=> Y = 81. Vậy khối lượng của nguyên tử đồng vị thứ hai của brom là 81.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây