Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. QUAN HỆ GIỮA VỊ TRÍ CỦA NGUYÊN TỐ VÀ CẤU TẠO NGUYÊN TỬ CỦA NÓ
Biết vị trí của một nguyên tố trong bảng tuần hoàn, có thể suy ra cấu tạo nguyên tử của nguyên tố đó và ngược lại.
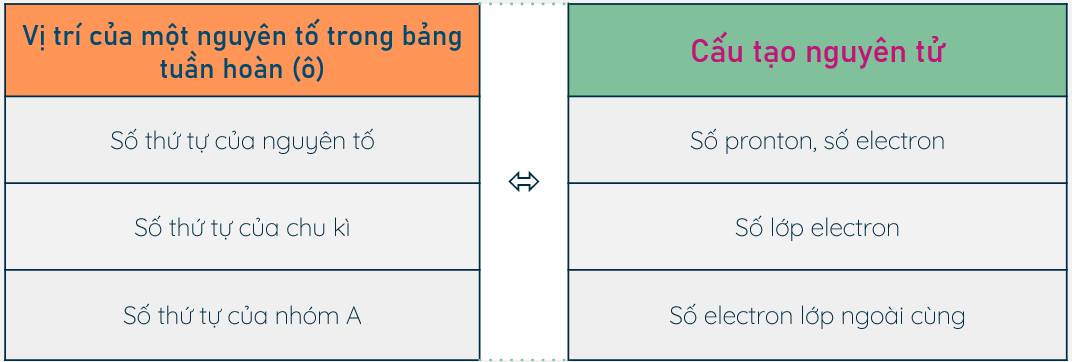
Ví dụ 1. Biết nguyên tố X có số thứ tự là 19 thuộc chu kì 4, nhóm IA ta có thể suy ra:
- Nguyên tử nguyên tố X có 19 proton, 19 electron.
- Nguyên tử đó có 4 lớp electron (vì số lớp electron bằng số thứ tự của chu kì).
- Có một electron ở lớp ngoài cùng (vì số electron ở lớp ngoài cùng bằng số thứ tự của nhóm A).
- Vậy nguyên tố X là kali.
Ví dụ 2. Biết cấu hình electron nguyên tử của một nguyên tố là 1s22s22p63s23p4 có thể suy ra:
- Tổng số electron của nguyên tử là 16, vậy nguyên tử đó nằm ở ô số 16 trong bảng tuần hoàn (vì nguyên tử có 16 electron, 16 proton, số đơn vị điện tích hạt nhân là 16, bằng số thứ tự của nguyên tố trong bảng tuần hoàn).
- Nguyên tố đó thuộc chu kì 3 (vì có 3 lớp electron), thuộc nhóm VIA (vì có 6 electron lớp ngoài cùng).
- Đó là nguyên tố lưu huỳnh.
II. QUAN HỆ GIỮA VỊ TRÍ VÀ TÍNH CHẤT CỦA NGUYÊN TỐ
Biết vị trí của một nguyên tố trong bảng tuần hoàn có thể suy ra những tính chất hóa học cơ bản của nó.
- Tính kim loại, phi kim
| Vị trí | Tính chất |
| IA, IIA, IIIA (trừ hidro và bo) | Tính kim loại |
| VA, VIA, VIIA (trừ antimon, bitmut và poloni) | Tính phi kim |
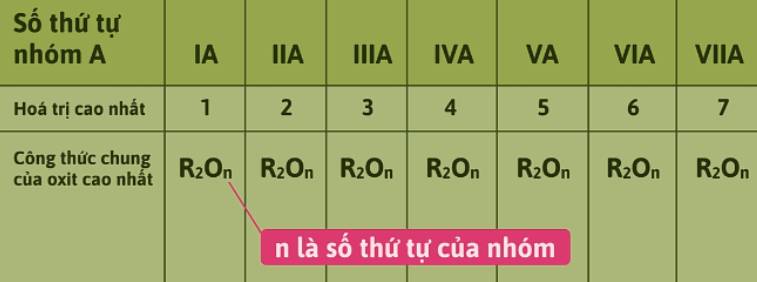
- Hóa trị cao nhất của nguyên tố trong hợp chất với oxi, hóa trị của nguyên tố trong hợp chất với hidro.
- Công thức oxit cao nhất.
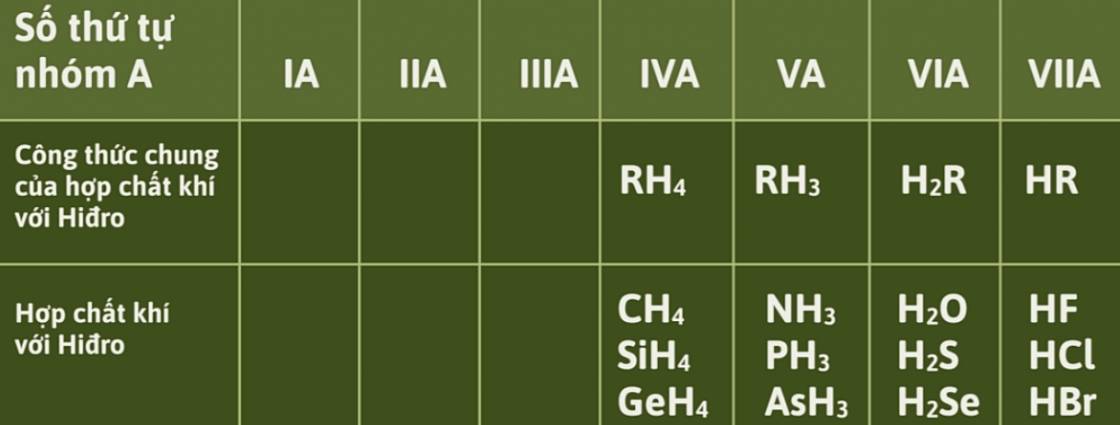
- Công thức hợp chất khí với hidro (nếu có).
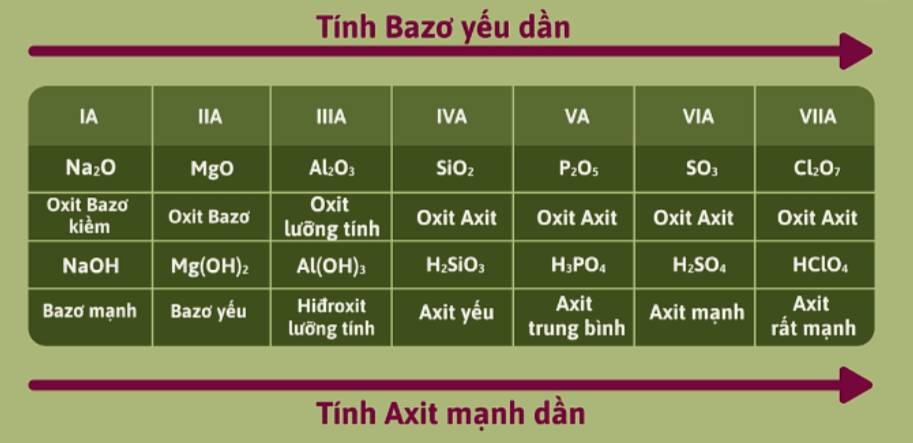
- Công thức hidroxit tương ứng (nếu có) và tính axit, bazơ của chúng.
Ví dụ: Nguyên tố lưu huỳnh ở ô thứ 16, nhóm VIA, chu kì 3. Suy ra:
- Lưu huỳnh là phi kim.
- Hóa trị cao nhất với oxi là 6, công thức oxit cao nhất là SO3.
- Hóa trị với hidro là 2, công thức với hợp chất khí với hidro là H2S.
- SO3 là oxit axit, H2SO4 là axit mạnh.
III. SO SÁNH TÍNH CHẤT HÓA HỌC CỦA MỘT NGUYÊN TỐ VỚI CÁC NGUYÊN TỐ LÂN CẬN
Dựa vào quy luật biến đổi tính chất của các nguyên tố trong bảng tuần hoàn có thể so sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân:
- Tính phi kim tăng dần, tính kim loại yếu dần.
- Oxit và hidroxit của các nguyên tố có tính bazơ có tính yếu dần đồng thời tính axit tăng dần.
Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân:
- Tính kim loại tăng dần, tính phi kim yếu dần.
- Oxit và hidroxit của các nguyên tố có tính bazơ tăng dần và tính axit giảm dần.
Ví dụ. So sánh tính chất hóa học của P (Z = 15) với Si (Z = 14) và S (Z = 16) với N (Z = 7) và As (Z = 33).
Trong bảng tuần hoàn, Si, P, S thuộc cùng một chu kì. Theo chiều tăng dần của điện tích hạt nhân ta có tính phi kim tăng nên tính phi kim của Si < P < S.
Trong nhóm VA, theo chiều tăng dần của điện tích hạt nhân ta có dãy N, P, As, tính phi kim giảm dần nên tính phi của N > P > As.
Vậy P có tính phi kim yếu hơn N và S, hidroxit của nó là H3PO4 có tính axit yếu hơn HNO3 và H2SO4.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây