(2 điểm) Cốc A chứa 50mL dung dịch KOH 0,1 M được chuẩn độ bằng dung dịch HNO3 0,1 M. Sau khi thêm 52 mL dung dịch HNO3 vào, pH của dung dịch trong cốc là bao nhiêu?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(NaCl\rightarrow Na^++Cl^-\\ H_3PO_4⇌H^++H_2PO_4^-\\ H_2PO_4^-⇌H^++HPO_4^{2-}\\ HPO_4^{2-}⇌H^++PO_4^{3-}\\ KNO_3\rightarrow K^++NO^-_3\\ CuSO_4\rightarrow Cu^{2+}+SO^{2-}_4\)

-acid sunfuric loãng là axit mạnh:
acid sunfuric đặc có tính oxi hóa mạnh:
( đặc tác dụng kim loại làm cho kim loại lên hóa trị cao nhất , và tạo ra sản phẩm khử )
- Tính acid:
Zn + H2SO4 → ZnSO4 + H2
CuO + H2SO4 → CuSO4 + H2O
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
CaCO3 + H2SO4 → CaSO4 + CO2 + H2O
- Tính oxi hóa mạnh:
Cu + 2H2SO4 đặc, nóng → CuSO4 + SO2 + 2H2O
- Tính háo nước:
C12H22O11 —> 12C + 11H2O

Cấu hình e (Z=7): \(1s^22s^22p^3\)
=> Nito có 2 lớp electron, có 5e lớp ngoài cùng
=> Thuộc chu kì 2, nhóm VA, ô thứ 7

Phú dưỡng là hệ quả sau khi ao hồ, sông ngòi tiếp nhận quá nhiều các nguồn thải chứa các chất dinh dưỡng (Nitơ, Photpho) vượt quá khả năng tự điều hòa của ao, hồ. Các nguồn thải xả thải cung cấp đầu vào cho quá trình này tăng lên từng ngày.
Nguyên nhân
nông dân sử dụng phân bón trong trồng trọt: Phân bón dường như là một phần không thể thiếu trong nông nghiệp, thúc đẩy quá trình phát triển của cây trồng. Cũng vì vậy, nhiều người lầm tưởng, bón càng nhiều phân càng tốt. Thực chất, cây trồng chỉ hấp thụ một lượng nhất định. Khi lượng này vượt quá khả năng đồng hóa của đất, chúng sẽ theo dòng chảy mặt ra ao, hồ.
sinh hoạt hàng ngày xả nước thải trực tiếp ra môi trường: chứa lượng chất hữu cơ rất lớn. Chúng bao gồm: nước thải nhà vệ sinh, rửa bát, làm sạch thực phẩm, chứa nhiều cặn thức ăn, dầu mỡ.
nước thải chăn nuôi: Đây là nguồn thải giàu chất hữu cơ nhất, thường đến từ các cơ sở chăn nuôi gia đình. Phân hữu cơ chứa lượng lớn nitơ và photpho đẩy quá trình phú dưỡng diễn ra theo tiến trình nhanh nhất.
tác hại nghiêm trọng của hiện tượng phú dưỡng
Hiện tượng này gây ra nhiều hậu quả cho môi trường tự nhiên, cân bằng sinh thái và chính con người:
gây mùi hôi thối:Nước bị phú dưỡng thường bốc mùi hôi thối, dòng chảy thấp, lưu lâu hơn. Đó là do mùi hôi của nước, cùng với mùi của cá, và các sinh vật chết.
Mất mỹ quanNước chuyển màu xanh của tảo, dày đặc trên mặt nước gây mất mỹ quan môi trường.
Ảnh hướng tới thủy sinhHiện tượng phú dưỡng là nguyên nhân hàng đầu làm suy giảm hệ sinh thái ven bờ và dưới nước. Đây là hậu quả nghiêm trọng và khó khắc phục nhất. Ban đầu, khi các chất dinh dưỡng dược bổ sung, các loài sinh vật như thực vật thủy sinh, cá, tảo sẽ cùng nhau phát triển mạnh.
Tuy nhiên, sau thời gian dài, khi lượng chất dinh dưỡng quá lớn, tảo lấn chiếm không gian, bao phủ mặt trên của hồ. Lớp tảo ngăn không cho các loài sinh vật khác tiếp cận với mặt trời và oxy. Đồng thời, các nhóm tảo mới liên tục sản sinh và một phần tảo chết đi, bị chìm xuống tầng nước sâu hơn.
Phần lớn oxy được vi sinh vật sử dụng, gần như toàn bộ lượng oxy trong nước. Vì vậy, khi tảo phát triển trên mặt, các loài sinh vật khác đều dần dần bị chết do thiếu oxy cho quá trình hô hấp.
Chất lượng nước bị suy giảmCác thành phần hóa học của nước bị thay đổi nghiêm trọng. Do dưới mặt nước, môi trường thiếu khí (thiếu oxy) được hình thành, với các sinh vật thiếu khí phân hủy sinh khối. Đồng thời diễn ra trong quá trình phân hủy hữu cơ, các hợp chất tự do độc hại như amoniac và hydro sunfua (H2S) được tạo ra.
Thay đổi độ đục và màu sắc của nướcDo các thành phần trong nước như thực vật, động vật phù du, vi sinh vật, nấm, bùn thay đổi. Nước bị phú dưỡng thường không còn trong như ban đầu, thay vào đó là màu đen, xám đặc trưng
Nguồn phát triển vi sinh vật, ruồi muỗi và bệnh tậtĐây là điều kiện tốt cho nhiều loài vi sinh vât gây bệnh phát triển. Với những người sống quanh khu vực có thể bị vấn đề về hô hấp. Trong trường hợp sử dụng nước ngầm, nguồn nước ô nhiễm từ ao có thể nhiễm vào, gây bệnh cho con người.

Gọi chung 2 KL cần tìm là A.
PT: \(2A+2HCl\rightarrow2ACl+H_2\)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_A=2n_{H_2}=0,6\left(mol\right)\)
\(\Rightarrow\overline{M}_A=\dfrac{18,6}{0,6}=31\left(g/mol\right)\)
Mà: 2 KL ở 2 chu kì kế tiếp nhau.
→ Na và K

a, \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
b, \(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
\(n_{Fe_2\left(SO_4\right)_3}=n_{Fe_2O_3}=0,1\left(mol\right)\Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,1.400=40\left(g\right)\)
c, \(n_{H_2SO_4}=3n_{Fe_2O_3}=0,3\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,3.98=29,4\left(g\right)\Rightarrow m_{ddH_2SO_4}=\dfrac{29,4}{9,8\%}=300\left(g\right)\)
\(\Rightarrow C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{40}{16+300}.100\%\approx12,66\%\)

(1) \(N_2+O_2\underrightarrow{^{3000^oC}}2NO\)
(2) \(2NO+O_2\rightarrow2NO_2\)
(3) \(4NO_2+O_2+2H_2O\rightarrow4HNO_3\)
(4) \(HNO_3+NH_3\rightarrow NH_4NO_3\)
(1) N2 + O2 —> 2NO
(2) 2NO + O2 → 2NO2
(3) 4NO2 + O2 + 2H2O → 4HNO3
(4) NH3 + HNO3 → NH4NO3

\(N_2+3H_2\underrightarrow{t^o}2NH_3\)
Ta có: \(K_C=\dfrac{\left[NH_3\right]^2}{\left[N_2\right]\left[H_2\right]^3}=\dfrac{0,6^2}{0,02.2^3}=2,25\)
Theo PT: \(\left[N_2\right]_{\left(pư\right)}=\dfrac{1}{2}\left[NH_3\right]=0,3\left(mol\right)\)
\(\Rightarrow H=\dfrac{0,3}{0,3+0,02}.100\%=93,75\%\)
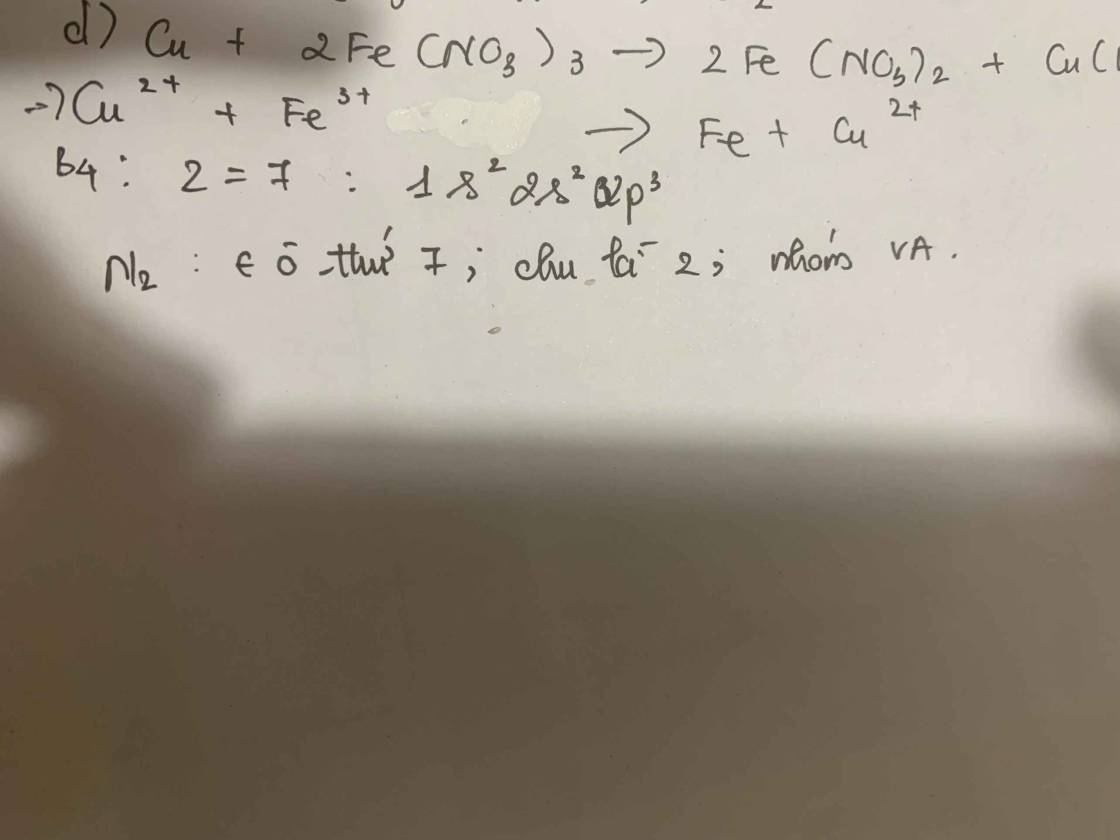
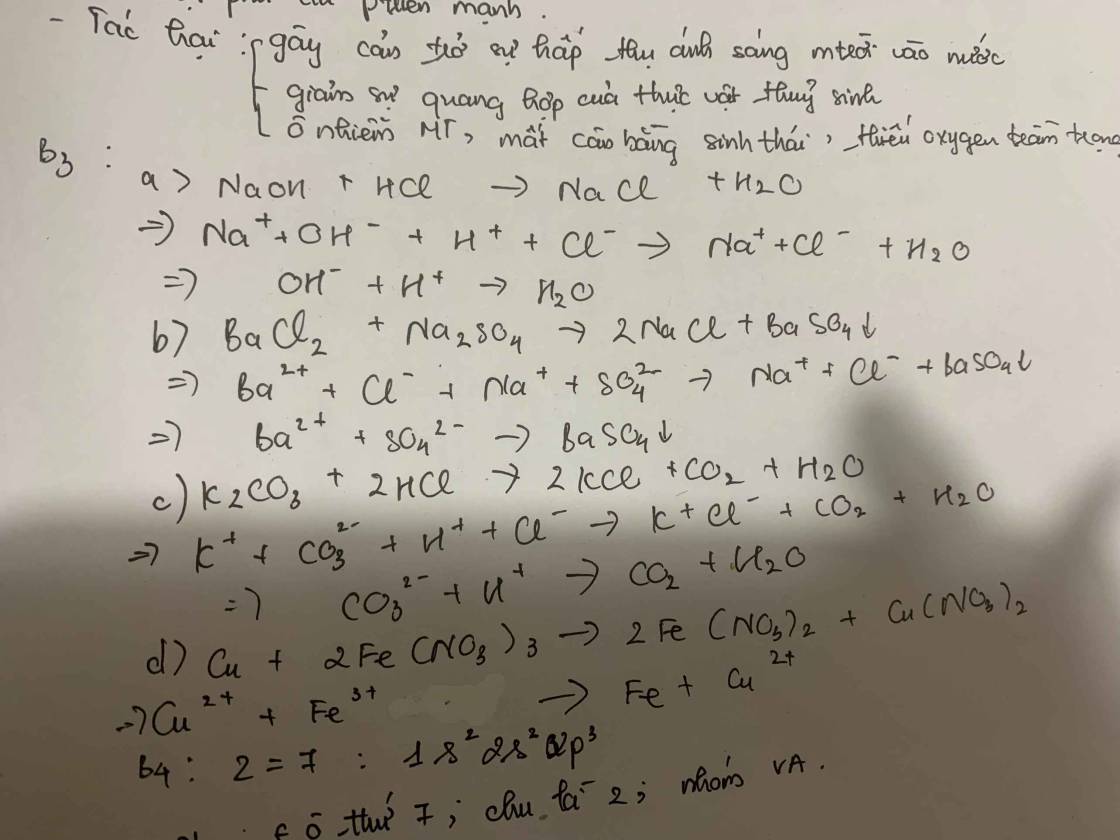
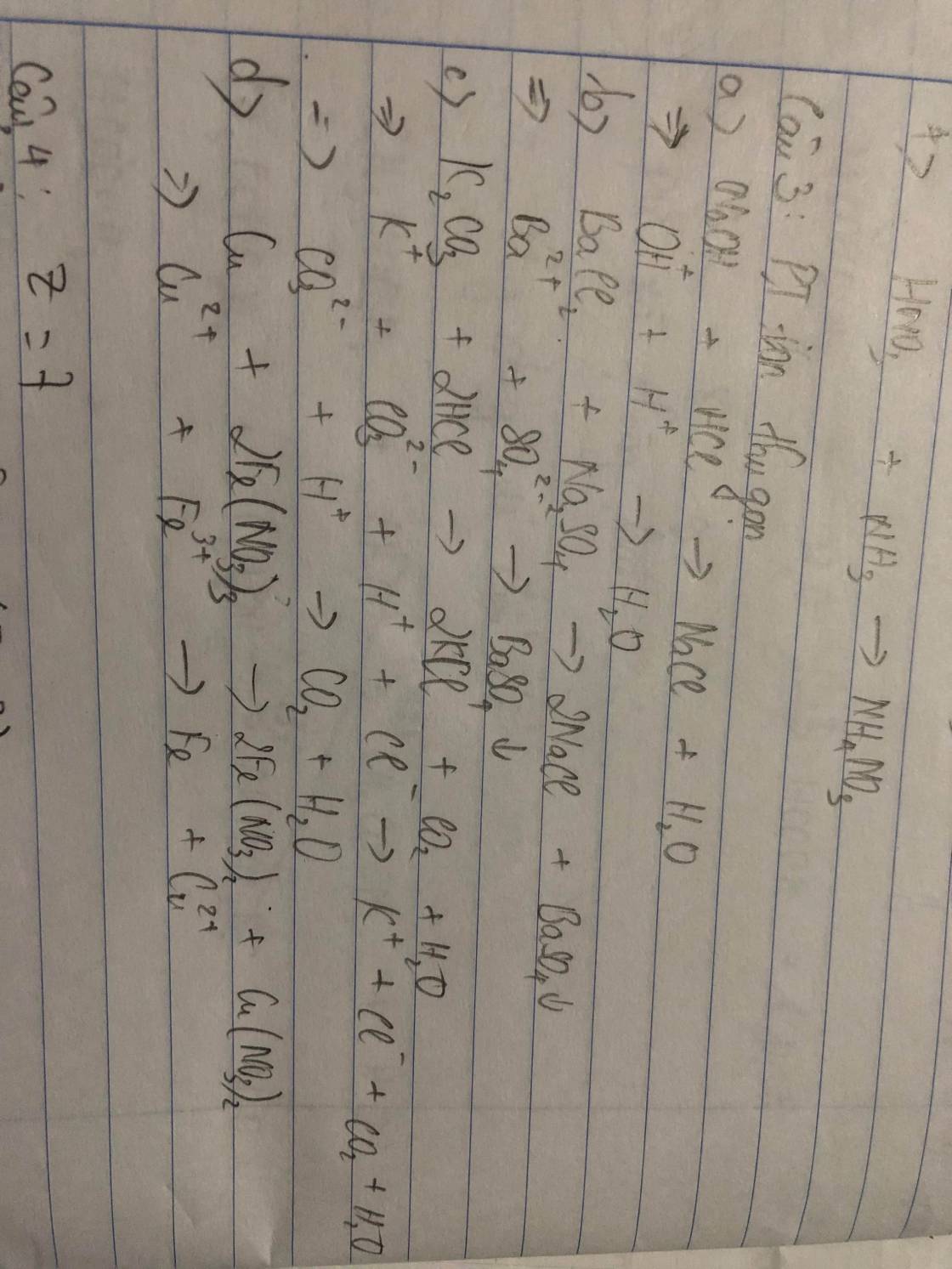

\(n_{OH^-}=0,05.0,1=0,005\left(mol\right)\\ n_{H^+}=0,1.0,052=0,0052\left(mol\right)\\ H^++OH^-\rightarrow H_2O\\ Vì:\dfrac{0,005}{1}< \dfrac{0,0052}{1}\Rightarrow H^+dư\\ n_{H^+\left(dư\right)}=0,0052-0,005=0,0002\left(mol\right)\\ \left[H^+\right]=\dfrac{0,0002}{0,102}=\dfrac{1}{510}\left(M\right)\\ pH=-log\left[H^+\right]=-log\left[\dfrac{1}{510}\right]\approx2,7076\)