Đốt 40,6g hợp kim gồm Al và Zn trong bình đựng khí clo dư. Sau một thời gian ngừng phản ứng thu được 65,45g hỗn hợp gồm 4 chất rắn (gồm muối clorua và kim loại). Cho hỗn hợp rắn này tam hết vào dung dịch HCl thì được V (lít) H2 (đktc). Dẫn V (lít) khí này đi qua ống chứa 80g CuO nóng. Sau một thời gian thấy trong ống còn lại 72,32g chất rắn và chỉ có 80% H2 đã phản ứng. Xác định % khối lượng các kim loại trong hợp kim Al-Zn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1./ Dẫn luồng khí H2 qua ống đựng CuO:
CuO + H2 → Cu + H2O
a a a
Khối lượng chất rắn giảm:
Δm = m(CuO pư) - m(Cu) = 80a - 64a = 80 - 72,32 = 7,68g
⇒ a = 7,68/16 = 0,48g
Số mol H2 tham gia pư: n(H2) = 0,48/80% = 0,6mol
Theo ĐL bảo toàn nguyên tố, số mol HCl tham gia pư là: n(HCl pư) = 2.n(H2) = 1,2mol
Theo ĐL bảo toàn khối lượng:
m(hh rắn) + m(HCl pư) = m(muối) + m(H2) ⇒ m(muối) = m(hh rắn) + m(HCl pư) - m(H2)
⇒ m(muối) = 65,45 + 0,12.36,5 - 0,6.2 = 108,05g
Gọi x, y là số mol Al và Zn có trong hh KL ban đầu.
m(hh KL) = m(Al) + m(Zn) = 27x + 65y = 40,6g
m(muối) = m(AlCl3) + m(ZnCl2) = 133,5x + 136y = 108,05g
⇒ x = 0,3mol và y = 0,5mol
Khối lượng mỗi kim loại:
m(Al) = 0,3.27 = 8,1g; m(Zn) = 65.0,5 = 32,5g
Thành phần % khối lượng mỗi kim loại:
%Al = 8,1/40,6 .100% = 19,95%
%Zn = 32,5/40,6 .100% = 80,05%

Kim loại không tan là Cu dư.
Cu dư => Muối thu được gồm FeCl2 và CuCl2 vì: Cu + 2FeCl3 → CuCl2 + 2FeCl2
Số mol các chất là: 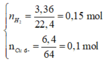
Sơ đồ phản ứng:
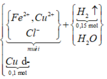
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Đáp án A.

\(m_{CuO_{giam}}=80-72,32=7,68g=m_O\)
\(\rightarrow n_O=0,48\left(mol\right)\)
\(PTHH:O+H_2\rightarrow H_2O\)
\(\rightarrow n_{H2_{pu}}=0,48\left(mol\right)\rightarrow\Sigma n_{H2}=0,48:80\%=0,6\left(mol\right)\)
Hỗn hợp 65, 45g gồm 2 kim loại và 2 muối :
Gọi x , y là số mol của Al , Zn bđ \(\rightarrow27x+65y=40,6\left(1\right)\)
\(\rightarrow n_{Al_{pu}}=kx;n_{Zn_{pu}}=ky\)
\(n_{Al_{du}}=x-kx=\left(1-k\right)x\left(mol\right)\)
\(n_{Zn_{du}}=y-ky=\left(1-k\right)y\left(mol\right)\)
\(PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\)
_______\(\left(1-k\right)x\) _____________\(1,5x\left(1-k\right)\)
\(PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\)
______\(\left(1-k\right)y\)_______________\(\left(1-k\right)y\)
\(\rightarrow\left(1-k\right)\left(1,5x+y\right)=0,6\left(2\right)\)
\(m_{tang}=m_{Cl2_{pu}}=65,45-40,6=24,85\rightarrow n_{Cl2}=0,3\%\left(mol\right)\)
\(2Al++3Cl_2\underrightarrow{^{to}}2AlCl_3\)
\(kx\)_____\(1,5xk\)_______
\(Zn+Cl_2\underrightarrow{^{to}}ZnCl_2\)
\(ky\)____\(ky\)________
\(\rightarrow k\left(1,5+y\right)=0,35\left(3\right)\)
Từ ( 2 ) và ( 3 ) \(\rightarrow1,5x+y=\frac{0,6}{1-k}=\frac{0,35}{k}\)
\(\Leftrightarrow0,6k=0,35-0,35k\Leftrightarrow k=\frac{7}{19}\)
Thay ( k ) vào ( 3 ) \(\rightarrow\frac{21}{38}x+\frac{7}{19}y=0,35\left(4\right)\)
Từ ( 1 ) và ( 4 ) \(\rightarrow\left\{{}\begin{matrix}x=0,3\\y=0,5\end{matrix}\right.\)
\(\rightarrow\%_{Al}=\frac{0,3.27.100}{40,6}=19,95\%\)
\(\%_{Zn}=100\%-19,95\%=80,05\%\)

n Mg = 3,6/24 = 0,15(mol)
n Al = 5,4/27 = 0,2(mol)
Gọi n Cl2 = a(mol) ; n O2 = b(mol)
Bảo toàn e :
2n Cl2 + 4n O2 = 2n Mg + 3n Al
<=> 2a + 4b = 0,15.2 + 0,2.3 = 0,9(1)
Bảo toàn khối lượng :
m X + m Al + m Mg = m Z
=> 71a + 32b = 29,95 - 3,6 -5,4 = 20,95(2)
Từ (1)(2) suy ra a = 0,25 ; b = 0,1
%m O2 = 0,1.32/(0,25.71 + 0,1.32) .100% = 15,27%

\(12,9g.hh\left\{{}\begin{matrix}Al:x\left(mol\right)\\Mg:y\left(mol\right)\end{matrix}\right.\underrightarrow{+Cl_2}Rắn.Y\left(37,45g\right)\underrightarrow{+HCl}H_2\left(64\%\right)\underrightarrow{+Fe_2O_3\left(50g\right)}Rắn\left(47,44g\right)\)
BTKL: \(m_X+m_{Cl_2}=m_Y\Rightarrow n_{Cl_2}=0,35\left(mol\right)\)
\(m_{Fe_2O_3}=m_{rắn}+m_{O\left(oxit\right)}\Rightarrow m_O=2,56\left(g\right)\\ \Rightarrow n_O=n_{H_2.pứ}=\dfrac{2,56}{16}=0,16\left(mol\right)\)
\(\Rightarrow n_{H_2.thoát.ra}=\dfrac{0,16}{64\%}.100\%=0,25\left(mol\right)\)
Bảo toàn mol e:
| Cho e | Nhận e |
| Mg - 2e --> \(Mg^{+2}\) | \(Cl_2^0+2e\) --> \(2Cl^-\) |
| x -> 2x | 0,35-> 0,7 |
| Al - 3e --> \(Al^{+3}\) | \(2H^++2e\) --> \(H_2\) |
| y -> 3y | 0,5<- 0,25 |
| \(N_e.cho=2x+3y\) | \(N_e.nhận=0,7+0,5=1,2\) |
\(\Rightarrow\left\{{}\begin{matrix}27x+24y=12,6\\2x+3y=1,2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=\dfrac{3}{11}\\y=\dfrac{12}{55}\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%_{m_{Al}}=\dfrac{\dfrac{3}{11}.27.100\%}{12,6}=58,44\%\\\%_{m_{Mg}}=\dfrac{\dfrac{12}{55}.24.100\%}{12,6}=41,56\%\end{matrix}\right.\)
Bảo toàn khối lượng :
m O = 80 - 72,32 = 7,68 gam
n O = 7,68/16 = 0,48(mol)
$H_2 + O_{oxit} \to H_2O$
n H2 pư = n O = 0,48(mol)
=> n H2 = 0,48/80% = 0,6(mol)
Gọi n Al = a(mol) ; n Zn = b(mol)
=> 27a + 65b = 40,6 (1)
Bảo toàn khối lượng :
n Cl2 pư = 65,45 - 40,6 = 24,85(gam)
n Cl2 = 24,85/71 = 0,35(mol)
Bảo toàn electron :
3n Al + 2n Zn = 2n Cl2 + 2n H2
<=> 3a + 2b = 0,35.2 + 0,6.2(2)
Từ (1)(2) suy ra a = 0,3 ; b = 0,5
%m Al = 0,3.27/20,6 .100% = 20%
%m Fe = 100% -20% = 80%
Làm sao biết bảo toàn electron đó như nào ạ??
3nAl +2nZn=... đó ạ