Tính toán và trình bày phương xác định nồng độ % và nồng độ mol của 1 mẫu dd CuSO4 trong phòng thí nghiệm
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


* Phương pháp xác định nồng độ phần trăm dung dịch C u S O 4
- Cân một lượng dung dịch C u S O 4 xác định.
- Cô cạn dung dịch cho đến khi thu được chất rắn màu trắng đó là C u S O 4 . Sau đó đem cân lượng muối sau khi cô cạn này ta được số liệu là mct.
- Áp dụng công thức: 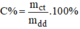 ta sẽ tính C% của dung dịch
C
u
S
O
4
.
ta sẽ tính C% của dung dịch
C
u
S
O
4
.
* Phương pháp xác định nồng độ mol của dung dịch C u S O 4 :
- Đong 1 thể tích dung dịch C u S O 4 xác định, đem cân lượng dung dịch đó.
- Sau đó dùng công thức 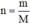 để tính số mol của
C
u
S
O
4
.
để tính số mol của
C
u
S
O
4
.
- Tính nồng độ mol của dung dịch
C
u
S
O
4
bằng công thức: 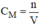

Bài 1: Bạn tự học nhé
Bài 2:
\(C_M=\dfrac{n}{V}=\dfrac{2,5}{4}=0,625M\)
Bài 3:
\(a,CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\\ b,SO_3+H_2O\rightarrow H_2SO_4\)
Bài 4:
a, HNO3 - axit nitric
Ca(OH)2 - canxi hiđroxit
b, K2SO4
NaHCO3
mình làm nốt bài 1 :)))
oxit là 1 hợp chất trong đó có 1 hay nhiều nguyên tử Oxi liên kết với 1 đơn chất
VD : CO2 , FeO

a)
\(Fe + CuSO_4 \to FeSO_4 + Cu\)
Theo PTHH :
\(n_{CuSO_4} = n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)\\ \Rightarrow V_{dd\ CuSO_4} = \dfrac{0,2}{0,1} = 2(lít)\)
b)
\(n_{CuSO_4} = 0,1.2,5 = 0,25(mol) > n_{Fe}= 0,2\) nên \(CuSO_4\) dư.
Ta có :
\(n_{CuSO_4\ pư} = n_{FeSO_4} = n_{Fe} = 0,2(mol)\\ \Rightarrow n_{CuSO_4\ dư} = 0,25 - 0,2 = 0,05(mol)\)
Vậy :
\(C_{M_{CuSO_4}} = \dfrac{0,05}{2,5} = 0,02M\\ C_{M_{FeSO_4}} = \dfrac{0,2}{2,5} = 0,08M\)

trình bày phương pháp thực nghiệm để xác định nồng độ % và nồng độ mol của một mẫu thử dung dịch CuSO4
Trả lời
a) Phương pháp xác định nồng độ phần trăm của dung dịch CuSO4 .
– Cân lấy một lượng dung dịch CuSO4 tuỳ ý, ví dụ 100 g.
– Cô cạn dung dịch cho đến khi thu được chất rắn màu trắng là CuSO4.
– Cân muối CuSO4 thu được sau khi cô cạn, thí dụ được 8 g.
– Tính nồng độ phần trăm của dung dịch CuSO4 ban đầu :
C%=100%×8100=8%
b) Phương pháp xác định nồng độ mol của dung dịch CuSO4 :
– Cân lấy một lượng dung dịch CuSO4 tuỳ ý rồi đo thể tích. Thí dụ, cân lấy 100 g dung dịch CuSO4 như trong thí nghiệm trên, đo thể tích được 90 ml.
– Tính số mol CuSO4 có trong 90 ml (hoặc 100 g) dung dịch là :
nCuSO4=8160=0,05(mol)
– Tính nồng độ mol của dung dịch CuSO4 :
a) Phương pháp xác định nồng độ phần trăm của dung dịch CuSO4 .
– Cân lấy một lượng dung dịch CuSO4 tuỳ ý, ví dụ 100 g.
– Cô cạn dung dịch cho đến khi thu được chất rắn màu trắng là CuSO4.
– Cân muối CuSO4 thu được sau khi cô cạn, thí dụ được 8 g.
– Tính nồng độ phần trăm của dung dịch CuSO4 ban đầu :
C% = (100%×8):100=8%
b) Phương pháp xác định nồng độ mol của dung dịch CuSO4 :
– Cân lấy một lượng dung dịch CuSO4 tuỳ ý rồi đo thể tích. Thí dụ, cân lấy 100 g dung dịch CuSO4 như trong thí nghiệm trên, đo thể tích được 90 ml.
– Tính số mol CuSO4 có trong 90 ml (hoặc 100 g) dung dịch là :
\(_{n_{CuSO4}}\) = 8:160=0,05(mol)
– Tính nồng độ mol của dung dịch CuSO4 :
\(_{C_M}\)= (1000×0,05) : 90 ≈ 0,56(mol/l)

Đáp án C
So với TN1, TN2 có nồng độ chất B giảm 2 lần, nồng độ chất A giữ nguyên, làm cho tốc độ phản ứng giảm 2 lần. Kết luận tốc độ phản ứng tỉ lệ thuận với nồng độ chất B.
So với TN1, TN3 có nồng độ chất A tăng 4 lần, nồng độ chất B giữ nguyên, làm cho tốc độ phản ứng tăng 16 lần. Kết luận tốc độ phản ứng tỉ lệ thuận với bình phương nồng độ chất A

Đổi 500ml = 0,5l
\(C_{M\left(C\text{uS}O_4\right)}=\dfrac{n}{V_{\text{dd}}}=\dfrac{0,6}{0,5}=1,2M\)

\(n_{CuSO_4}=\dfrac{400}{160}=2,5\left(mol\right)\)
\(400ml=0,4\left(l\right)\)
\(C_{M_{CuSO_4}}=\dfrac{2,5}{0,4}=6,25\left(M\right)\)

Refer.
Phương pháp xác định nồng độ phần trăm của dung dịch CuSO4 .
– Cân lấy một lượng dung dịch CuSO4 tuỳ ý, ví dụ 100 g.
– Cô cạn dung dịch cho đến khi thu được chất rắn màu trắng là CuSO4.
– Cân muối CuSO4 thu được sau khi cô cạn, thí dụ được 8 g.
– Tính nồng độ phần trăm của dung dịch CuSO4 ban đầu :
\(C\%=\dfrac{8}{100}\cdot100\%=8\%\)
Phương pháp xác định nồng độ mol của dung dịch CuSO4 :
– Cân lấy một lượng dung dịch CuSO4 tuỳ ý rồi đo thể tích. Thí dụ, cân lấy 100 g dung dịch CuSO4 như trong thí nghiệm trên, đo thể tích được 90 ml.
– Tính số mol CuSO4 có trong 90 ml (hoặc 100 g) dung dịch là :
\(n_{CuSO_4}=\dfrac{8}{160}=0.05\left(mol\right)\)
– Tính nồng độ mol của dung dịch CuSO4 :
\(C_M=\dfrac{1000\cdot0.05}{90}=0.56\left(M\right)\)