Câu 72) khi phân tích một mẫu quặng apatit Ca3(PO4)2 có chứa 6,1 g P. Hỏi mẫy quặng trên có chứa bao nhiêu gam Ca3(PO4)2 A . 32g B. 31g C.30,5g D. 41g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_P=\frac{6,2}{31}=0,2\left(mol\right)\)
\(n_{Ca3\left(PO4\right)2}=\frac{1}{2}n_P=0,1\left(mol\right)\)
\(m_{Ca3\left(PO4\right)2}=370.0,1=37\left(g\right)\)
\(n_P=\frac{6,2}{31}=0,2\left(mol\right)\)
\(n_{Ca3\left(PO4\right)2}=\frac{1}{2}n_P=0,1\left(mol\right)\)
\(m_{Ca3\left(PO4\right)2}=0,1.310=31\left(g\right)\)

\(n_{Ca\left(H_2PO_4\right)_2}=\dfrac{234}{234}=1\left(kmol\right)\)
Từ PTHH ta thấy :
\(n_{Ca_3\left(PO_4\right)_2}=\dfrac{1}{3}\left(kmol\right)\)
\(n_{Ca_3\left(PO_4\right)_2\left(tt\right)}=\dfrac{1}{3\cdot80\%}=\dfrac{5}{12}\left(kmol\right)\)
\(m_{Ca_3\left(PO_4\right)_2}=\dfrac{5}{12}\cdot310=\dfrac{775}{6}\left(kg\right)\)
\(m_{quặng}=\dfrac{775}{6\cdot38.75\%}=333.3\left(kg\right)\)

Trong 1000g quặng có: 1000. 35% = 350g Ca3(PO4)2
Bảo toàn nguyên tố P ⇒ trong 1 mol Ca3(PO4)2 có 1mol P2O5 nghĩa là trong 310g Ca3(PO4)2 tương ứng có 142g P2O5.
⇒350g Ca3(PO4)2 có lượng P2O5 là:
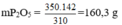
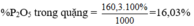

Đáp án B
Giả sử m = 1 kg = 1000g => mCa3(PO4)2=930 gam => nCa3(PO4)2= 930/310 = 3mol
Ca3(PO4)2+2H2SO4 (đặc)→Ca(H2PO4)2+2CaSO4↓
3 3
Ca(H2PO4)2→P2O5
3 3
=> %mP2O5 = 3.142/1000=42,6%

\(m_{Ca_3\left(PO_4\right)_2}=5.35\%=1,75\left(tấn\right)\)
Trong 1 mol Ca3(PO4)2 có 1 mol P2O5
=> Trong 310 tấn Ca3(PO4)2 tương ứng có 142 tấn P2O5
=> Trong 1,75 tấn Ca3(PO4)2 tương ứng có x tấn P2O5
=> x=\(\dfrac{1,75.142}{310}=0,8\left(tấn\right)\)
=> Chọn B
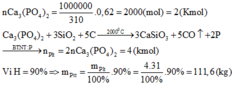
$n_P = \dfrac{6,1}{31} = 0,2(mol)$
Bảo toàn nguyên tố với P :
$n_{Ca_3(PO_4)_2} = \dfrac{1}{2}n_P = 0,1(mol)$
$m_{Ca_3(PO_4)_2} = 0,1.310 = 31(gam)$
Đáp án B