một nhà máy cần thu 50000l khí sunfurơ mỗi ngày. Hỏi để thu được lượng khí trên thì nhà ,áy cần sử dụng bao nhiêu tấn quặng pirit sắt. Giả sử quặng pirit chứa 98% FeS2, hiệu suất phản ứng là 95%(khi đo ở đktc)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


4 FeS2 + 11 O2 -to-> 2 Fe2O3 + 8 SO2
5.105<----------------------------------106 (mol)
SO2 + 1/2 O2 -to-> SO3
106<--------------------106 (mol)
SO3 + H2O -> H2SO4
106<---------------106 (mol)
mH2SO4= 98% x 100=98(tấn)
=> nH2SO4= (98.106)/98=106 (mol)
n(FeS2,thực tế)= (5.105): 90%= 5000000/9 (mol)
=> mFeS2(thực tế)= 5000000/9 x 120 = (2.108)/3 (g)
=> m(quặng pirit)= (2.108)/3 : 96% \(\approx\) 69 444 444,444 (g) \(\approx\) 69,44444444 (tấn)

\(n_{Fe} = \dfrac{5000.1000}{56} = \dfrac{625000}{7}\ kmol\\ n_{FeS_2\ đã\ dùng} = \dfrac{n_{Fe}}{H\%} = \dfrac{\dfrac{625000}{7}}{89,6\%} = 99649,23\ kmol\\ m_{quăng\ pirit} = \dfrac{m_{FeS_2}}{90\%} = \dfrac{99649,23.120}{90\%} = 13259897,33 (kg) = 13259,89(tấn)\)
\(n_{Fe}=\dfrac{5000\cdot10^6}{56}=\dfrac{625}{7}\cdot10^6\left(mol\right)\)
\(BTFe:\)
\(n_{FeS_2}=n_{Fe}=\dfrac{625}{7}\cdot10^6\left(mol\right)\)
\(n_{FeS_2\left(tt\right)}=\dfrac{\dfrac{625}{7}\cdot10^6}{89.6}=\dfrac{56000\cdot10^6}{7}\left(mol\right)\)
\(\Rightarrow m_{FeS_2}=\dfrac{56000\cdot10^6\cdot120}{7}=960000\cdot10^6\left(g\right)=960000\left(tấn\right)\)
\(m_{quặng}=\dfrac{960000\cdot100}{90}=1066666.67\left(tấn\right)\)

4FeS2 + 11O2 --to--> 2Fe2O3 + 8SO2
=> Tổng hệ số chất sản phẩm là: 2+8 = 10

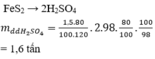
Quặng Pirit (FeS2)---------> SO2
Bảo toàn nguyên tố S: \(n_{FeS_2}.2=n_{SO_2}.1=\dfrac{50000}{22,4}=\dfrac{15625}{7}\Rightarrow n_{FeS_2}=\dfrac{15625}{14}\)(mol)
Vì H=95% => \(n_{FeS_2}=\dfrac{15625}{14}.\dfrac{100}{95}=1174,81\left(mol\right)\)
=> \(m_{FeS_2}=1174,81.120=140977,2\left(kg\right)\)
Vì quặng pirit chứa 98% FeS2
=> \(m_{quặng}=140977,2.\dfrac{100}{98}=143854,3\left(kg\right)\approx143,85\left(tấn\right)\)