1 đinh sắt khối lượng 50g cho vào dd CuSO4 sau 1 thời gian nhấc đinh sắt ra khỏi rồi rửa với nước sạch lau khô cân lại 51g a) tính khối lượng sắt tham gia và khối lượng đồng tạo thành b)Hỏi chiếc đinh sắt sau phản ứng có bao nhiêu gam sắt( giả sử toàn bộ đồng bám lên đinh sắt)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PTHH: Fe + CuSO4 --> FeSO4 + Cu
______a------------------------------>a
=> 64a - 56a = 0,2
=> 0,025 (mol)
=> mFe(pư) = 0,025.56 = 1,4 (g)
=> mCu = 0,025.64 = 1,6 (g)

Đặt nFe(pứ)=a(mol)
PTHH Fe +CuSO4------>FeSO4+Cu
Theo phương trình =>nFe=nCu=a(mol)
mđinh sắt tăng=mcu-mFe=64a-56a=0,2(g)
=>a=0,025(mol)
=>mFe(pứ)=0,025.56=1,4(g)
mCu=0,025.64=1,6(g)

\(Fe\left(x\right)+CuSO_4\rightarrow FeSO_4+Cu\left(x\right)\)
Khối lượng thanh sắt tăng thêm đúng bằng khối lượng Cu thêm vào trừ đi khối lượng Fe tham gia phản ứng.
Gọi số mol của Fe tham gia phản ứng là x
\(64x-56x=51-50=1\)
\(\Leftrightarrow x=0,125\)
\(\Rightarrow m_{Fe\left(pứ\right)}=56.0,125=7\)

Tham khảo:
PTHH: Fe + CuSo4 ---->FeSo4 + Cu
Gọi a(mol) là số mol của Fe phản ứng
mCu - mFe = 3.5 - 2.3 = 1.2(g)
<--> 64a - 56a = 1.2
<--> 8a = 1.2
<--> a = 0.15
Dựa vào PTHH: nFe = nFeSo4 = 0.15(mol)
--> mFeSo4 = 0.15×152 = 22.8(g)

Gọi a là số mol C u S O 4 tham gia phản ứng
Phương trình hóa học:
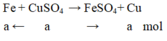
Theo đề bài ta có: m C u b á m v à o – m F e tan r a = m K L t ă n g
64a – 56a = 0,8 ⇒ a = 0,01 mol
Nồng độ dung dịch C u S O 4 là: C M = n V = 0,01 0,2 = 0,5 M
⇒ Chọn C.

Fe + CuSO4 → FeSO4 + Cu
1mol 1 mol => tăng 8 gam
x mol x mol tăng 0,8gam
=> x= 0,8:8= 0,1 mol
=> CM ( dung dịch CuSO4) = 0,1:0,2= 0,5 M
Bài 3 :
Pt : \(Fe+CuSO_4\rightarrow FeSO_4+Cu|\)
1 1 1 1
x 0,1 x
Gọi x là số mol của Fe
Vì khối lượng của sắt tăng so với ban đầu nên ta có phương trình :
\(m_{Cu}-m_{Fe}=0,8\left(g\right)\)
64x - 56x = 0,8
8x = 0,8
⇒x = \(\dfrac{0,8}{8}=0,1\)
\(n_{CuSO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
200ml = 0,2l
\(C_{M_{ddCuSO4}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
Chúc bạn học tốt


\(n_{Fe}=a\left(mol\right)\)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
\(a............................a\)
\(m_{tăng}=m_{Cu}-m_{Fe}=64a-56a=51-50=1\left(g\right)\)
\(\Rightarrow a=0.125\left(mol\right)\)
\(m_{Fe}=0.125\cdot56=7\left(g\right)\)
\(m_{Cu}=0.125\cdot64=8\left(g\right)\)
\(m_{Fe\left(dư\right)}=50-7=43\left(g\right)\)