Đốt cháy hết 672 ml (đktc) hỗn hợp khí gồm hai anken A, B kế tiếp nhau trong dãy đồng đẳng của etilen, thu được 4,4 gam khí CO2. Công thức phân tử của hai anken đem đốt
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đặt công thức phân tử của 2 anken X,Y lần lượt là CnH2n:a mol và Cn+1H2n+2:b mol(vì đồng đẳng hơn kém nhau 1 gốc (-CH2-).
nA=0,5(mol)
nH2O=1,3(mol)
PTHH: CnH2n+1,5nO2=nCO2+nH2O
C(n+1)H(2n+2) + (1,5n+1,5)O2=(n+1)CO2+(n+1)H2O
Dựa vào 2 phương trình ta được:
+Số mol nước:an+bn+b=1,3 suy ra n(a+b)+b=1,3(1)
+Số mol hỗn hợp A:a+b=0,5(2)
thay (2) vào (1) được:0,5n+b=1,3
Mà anken luôn có n≥2 và b nguyên dương nên dựa vào phương trình rút ra 1 nghiệm duy nhất là n=2.
Vậy CTPT của X:C2H4.CTCT của X:CH2=CH2
CTPT của Y:C3H6.CTCT của Y:CH3=CH3

Đáp án là B
![]() =0.6 mol <
=0.6 mol < ![]() =0.85 mol
=0.85 mol
->2 anol no đơn chức kế tiếp và ![]() =0,85-0,6=0,25 mol
=0,85-0,6=0,25 mol
![]() =0,6:0,25=2,4
=0,6:0,25=2,4
-> ![]()

Đặt công thức trung bình của 2 ancol ban đầu là CnH2n+2O: x (mol);
anken tạo thành là CnH2n : x (mol);
Pt đốt cháy
CnH2n + (3n/2) O2 → nCO2 + nH2O
Sau khi loại bỏ hơi nước thu được
O2 dư: 0,1 - (3n/2)x (mol)
và CO2: nx (mol)
→ 0,1 - (3n/2)x + nx = 0,07 → nx= 0,06;
Pt khối lượng ancol ban đầu: (14n+18)x = 1,08
→ x = 1/75 → n = 4,5 → C4H8 và C5H10

Hướng dẫn giải
nCO2 = 0,155 mol; nA = 0,155/ n ¯ => MA = 26,4n => n ¯ = 2,6
Chọn B

n CO2=0.4
nH20=0.75
ta có anken nên cháy tạo nCO2=nH20 nên n H2=0.3
n 2 anken=0.2 nên số C trung bình=0.45/0.22.25 vậy 2 anken là C2H4 và C3H8
Đáp án C


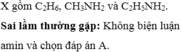

\(n_{hh}=\dfrac{0,672}{22,4}=0,03\left(mol\right)\)
\(n_C=\dfrac{4,4}{44}=0,1\left(mol\right)\)
=> \(\overline{SốC}=\dfrac{n_{CO_2}}{n_{hh}}=\dfrac{0,1}{0,03}=3,33\)
Vì hai anken A, B kế tiếp nhau trong dãy đồng đẳng của etilen
=> CTPT 2 anken cần tìm là C3H6 và C4H8