Hỗn hợp A gồm 2 kim loại kiềm thuộc 2 chu kì liên tiếp tác dụng hết với H2O được dung dịch B. Thêm vào B 100 ml dung dịch HCl 0,8M. Sau đó thêm tiếp 0,8g NaOH để trung hòa HCl dư được dung dịch C. Cô cạn C được 5,4g muối. Xác định 2 kim loại kiềm và khối lượng mỗi kim loại.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi CTHH chung của axit là RCOOH
Đổi: \(\left\{{}\begin{matrix}75ml=0,075l\\25ml=0,025l\end{matrix}\right.\)
\(n_{NaOH}=0,075.0,2=0,015\left(mol\right)\)
\(n_{HCl}=0,025.0,2=0,005\left(mol\right)\)
PTHH: NaOH + HCl ---> NaCl + H2O
0,005<---0,005->0,005
=> nNaOH (phản ứng với axit hữu cơ) = 0,015 - 0,005 = 0,01 (mol)
mNaCl = 0,005.58,5 = 0,2925 (g)
=> mmuối Na hữu cơ = 1,0425 - 0,2925 = 0,75 (g)
PTHH:
RCOOH + NaOH ---> RCOONa + H2O (1)
Theo pthh (1): naxit = nH2O = nNaOH = 0,01 (mol)
Áp dụng ĐLBTKL:
\(m_{axit}+m_{NaOH}=m_{muối}+m_{H_2O}\\ \Leftrightarrow m_{axit}=0,75+0,01.18-0,01.40=0,53\left(g\right)\)
=> \(M_{RCOOH}=\dfrac{0,53}{0,01}=53\left(\dfrac{g}{mol}\right)\)
=> \(M_R=53-45=8\left(\dfrac{g}{mol}\right)\)
=> \(m_{C\left(R_1\right)}< 8< m_{C\left(R_2\right)}\)
=> \(n_{C\left(R_1\right)}< \dfrac{2}{3}< n_{C\left(R_2\right)}\)
Mà số nguyên tử cacbon là số nguyên không âm
=> Một axit có 0 nguyên tử cacbon và một axit có 1 nguyên tử cacbon
=> 2 axit lần lượt là HCOOH và CH3COOH
P/s: CTHH dạng chung là CnH2n+1COOH nhé :)

xin lỗi thầy. bài này em tính toán nhầm nên đã làm lại được rồi.

Coi hai nguyên tố là R \(\Rightarrow\overline{M}=M_R\)
a, PTHH:
\(2R+2H_2O\rightarrow2ROH+H_2\uparrow\)
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\Rightarrow n_R=2n_{H_2}=0,3\left(mol\right)\)
Khi đó \(\overline{M}=M_R=\dfrac{9,3}{0,3}=31\left(g/mol\right)\)
\(\Rightarrow\) Hai nguyên tố lần lượt là Na, K
b, PTHH:
\(2ROH+H_2SO_4\rightarrow R_2SO_4+2H_2O\)
\(\Rightarrow n_{H_2SO_4}=\dfrac{1}{2}n_{ROH}=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{n_{H_2SO_4}}{C_M}=\dfrac{0,15}{2}=0,075\left(l\right)\)
\(n_{R_2SO_4}=n_{H_2SO_4}=0,15\left(mol\right)\)
\(\Rightarrow m_{R_2SO_4}=0,15.\left(31.2+32+16.4\right)=23,7\left(g\right)\)

Gọi công thức trung bình của hai muối là: M ¯ 2 CO 3
Cho từ từ hỗn hợp muối cacbonat nên ta có phản ứng:
CO 3 2 - + 2 H + → CO 2 + H 2 O
Sau khi phản ứng với dung dịch axit, thêm Ba(OH)2 dư vào Y thấy xuất hiện kết tủa H+ hết và dư CO 3 2 -
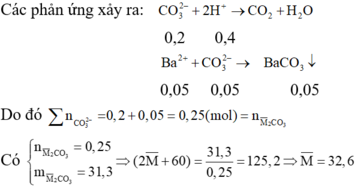
Vậy hai kim loại cần tìm là Na và K
Đáp án B.

Đáp án B
Gọi công thức trung bình của hai muối là: M2CO3.
Sau khi phản ứng với dung dịch axit, thêm Ba(OH)2 dư vào Y thấy xuất hiện kết tủa à H+ hết và dư CO32-
Các phản ứng xảy ra: CO32- + 2H+ → CO2 + H2O
0,2 0,4
CO32-dư + Ba2+ → BaCO3
0,05 0,05 0,05


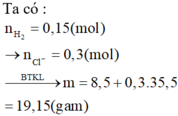
Coi hỗn hợp hai kim loại là R
2R + 2H2O → 2ROH + H2
$n_{HCl} = 0,1.0,8 = 0,08(mol) ; n_{NaOH} = \dfrac{0,8}{40} = 0,02(mol)$
NaOH + HCl → NaCl + H2O
0,02.........0,02...0,02......................(mol)
ROH + HCl → RCl + H2O
0,06....0,06......0,06...................(mol)
Suy ra: $0,02.58,5 + 0,06(R + 35,5) = 5,4 \Rightarrow R = 35$
Vậy hai kim loại là Natri(x mol) và Kali(y mol)
Ta có :
$x + y = 0,06$
$R = \dfrac{23x + 39y}{x + y} = \dfrac{23x + 39y}{0,06} = 35$
Suy ra x = 0,015 ; y = 0,045
$m_{Na} = 0,015.23 = 0,345(gam)$
$m_{Kali} = 0,045.39 = 1,755(gam)$