Cho a (g) bột kim loại M có hóa trị không đổi vào 500ml dd gồm Cu(NO3)2 và AgNO3 đêù có nồng độ 0,4M. Sau khi các pứ xảy ra hoàn toàn, đem lọc được (a + 27,2) g chất rắn gồm 3 kim loại và dd chỉ chứa 1 muối tan. Hãy xác định kim loại M và số mol muối tạo ra trong đ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

đề thiếu à bn? Cho a (g) bột kim loại M có hóa trị không đổi vào 500ml dd gồm Cu(NO3)2 và Alno3 đêù có nồng độ 0,4M? | Yahoo Hỏi & Đáp
nCu(NO3)2 = nAgNO3 = 0,4*0,5 = 0,2 mol
==> nCu(2+) = nAg(+) = 0,2 mol............nNO3(-) = 3*0,2 = 0,6 mol
vì sau phản ứng chỉ có muối duy nhất và 3 kim lại ==> M dư, muối đó là muối của kim loại M, Cu(2+) và Ag(+) bị dẩy ra khỏi muối.
khối lượng rắn tăng 27,2g = mCu + mAg - mM(phần kim loại M tham gia phản ứng)
.............==> nM(tham gia p.ứ) = 0,2*(108 + 64) - 27,2 = 7,2 g
gọi muối còn lại sau p.ứ là M(NO3)x với x là hóa trị của M biện luận:
+ nếu x = 1 ==> MNO3 (0,6 mol) tính theo số mol NO3(-) ==> mol M tham gia pứ = mol muối = 0,6 mol
==> NTK(M) = 7,2/0,6 = 12 ==> sai
+ nếu x = 2 ==> M(NO3)2 (0,3 mol) ==> mol M tgpứ = mol muối = 0,3 mol
==> NTK(M) = 7,2/0,3 = 24 ---> Mg --> mol muối Mg(NO3)2 = 0,2 mol
+ nếu x = 3 --> tương tự --> sai

Thứ tự trong dãy điện hóa: Al > Fe > Cu >Ag
=> Kim loại thu được gồm có Fe, Cu, Ag (đứng sau trong dãy điện hóa)
=> Đáp án B

Đặt nZn = x (mol) và nCu = 2x (mol)
(Vì hỗn hợp bột gồm Zn và Cu có tỉ lệ về số mol là 1:2)
⇒ mhỗn hợp = mZn + mCu
= 65x + 64 × 2x) = 19,3 g
⇒ x = 0,1 mol
Có nFe3+ = 0,4 mol. Xảy ra các quá trình sau:
PTHH: Zn + 2Fe3+ → Zn2+ + 2Fe2+
TPT: 1mol 2mol
TĐB: 0,1 → ?(mol)
=>nFe3+ = 0,1.2110,1.2 = 0,2(mol)
PTHH: Cu + 2Fe3+ → Cu2+ + 2Fe2+
TPT: 1mol 2mol
TĐB: ?(mol) ← 0,2(mol)
=> nCu= 0,2.12=0,1(���)20,2.1=0,1(mol)
⇒ m = mCu dư = 0,1 × 64 = 6,4 g
tick giúp tớ, cảm ơn bạn
Theo đề gọi \(n_{Zn}=x\left(mol\right),n_{Cu}=2x\left(mol\right)\)
Có:
\(m_{Zn}+m_{Cu}=19,3\\ \Leftrightarrow65x+64.2x=19,3\\ \Rightarrow x=0,1\)
=> Dung dịch sau \(\left\{{}\begin{matrix}SO_4^{2-}=0,6\\Fe^{2+}=0,4\\Zn^{2+}=0,1\\Cu^{2+}=0,1\end{matrix}\right.\)
\(\Rightarrow m_{kim.loại}=m_{Cu}=0,1.64=6,4\left(g\right)\)

Cho hỗn hợp X vào H2SO4 thu được (a+b)g --> hh X gồm oxit kim loại A và kim loại B
Trong đó: oxit kim loại A ko bị khử bởi CO, kim loại B ko tan trong d.d H2SO4
-->Dễ suy ra kim loại B là Cu
(*)Giả sử oxit kim loại A là AO
AO+H2SO4-->ASO4+H2O
1..........1..........1 mol
m d.d sau pư=A+16+980=A+996 g
C% ASO4=11,765%
\(\Rightarrow\frac{A+96}{A+996}=0,11765\)
\(\Rightarrow A=24\left(Mg\right)\)
(*) Giả sử là A2O3 làm tương tự -->loại
Nếu ko chia trường hợp thì gọi là A2Ox hoặc AxOy

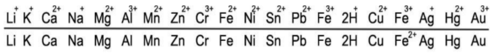
Theo dãy điện hóa ta có:
+ 2 muối lấy từ trước về sau lần lượt là: Fe(NO3)2 và Cu(NO3)2.
+ 2 kim loại lấy từ sau về trước là: Ag và Cu.
Đáp án C

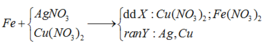
Cho em hỏi là: minh viết PT thì viết PT tác dụng với Cu trước hay Ag trước