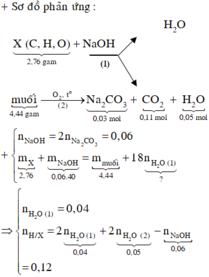
Chất hữu cơ A chỉ chứa C, H, O có CTPT trùng CTĐGN. Cho 2,76 gam A tác dụng với 1 lượng vừa đủ NaOH, chưng khô thì phần bay hơi chỉ có H2O phần chất rắn khan chứa 2 muối có khối lượng 4,44 gam. Đốt cháy hoàn toàn 2 muối này được 3,18 gam Na2CO3 2,464 lít CO2 (đktc) và 0,9 gam H2O. Nếu đốt cháy 2,76 gam A thì khối lượng H2O thu được là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C.
Phần bay hơi chỉ có H2O, không có ancol, đồng thời sản phẩm lại có hai muối Na nên X là este của phenol, có thể tạp chức.
![]()
Theo định luật bảo toàn khối lượng:
mmuối ![]()
Theo định luât bảo toàn nguyên tố O: nO muối = ![]()
Muối gồm hai dạng - ONa (a mol); - COONa (b mol)
Theo định luật bảo toàn nguyên tố Na và O: a + b = 0 , 06 a + 2 b = 0 , 08 . =>a = 0,04; b = 0,02.
Do đó X phải là este đơn chức của phenol 2 chức, X có dạng RC6H3(OH) - OOCR’.
Số mol chất X: nY = b = 0,02 mol => nO trong X = 0,06 mol.
Theo đinh luât bảo toàn khối lương: mX = mC + mH + mO =>nH trong X = 0,12 mol
=> nC : nH : nO = 7 : 6 : 3 =>công thức phân tử X là C7H6O3.
Có 3 công thức cấu tạo thỏa mãn với bài toán.

Chọn D
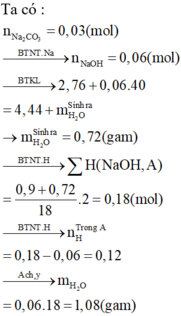
nNa2CO3 = 0,03; nCO2 = 0,11; nH2O (2) = 0,05 ⇒ nC = 0,14
Bảo toàn Na ⇒ nNaOH = 2nNa2CO3 = 0,06
BTKL ⇒ mH2O (1) = 2,76 + 0,06.40 – 4,44 = 0,72g ⇒ nH2O (1) = 0,04
Bảo toàn H ⇒ nH trong X = 2nH2O – nNaOH = 2.(0,05 + 0,04) – 0,06 = 0,12
Bảo toàn khối lượng ⇒ mO = 2,76 – 0,14.12 – 0,12 = 0,96g
⇒ %mO = 34,78%

nNa2CO3 = 0,03; nCO2 = 0,11;
nH2O (2) = 0,05
![]() nC = 0,14
nC = 0,14
Bảo toàn Na
![]() nNaOH = 2nNa2CO3 = 0,06
nNaOH = 2nNa2CO3 = 0,06
BTKL
![]() mH2O (1) = 2,76 + 0,06.40 – 4,44 = 0,72g
mH2O (1) = 2,76 + 0,06.40 – 4,44 = 0,72g
![]() nH2O (1) = 0,04
nH2O (1) = 0,04
Bảo toàn H
![]() nH trong X = 2nH2O – nNaOH
nH trong X = 2nH2O – nNaOH
= 2.(0,05 + 0,04) – 0,06 = 0,12
Bảo toàn khối lượng
![]() mO = 2,76 – 0,14.12 – 0,12 = 0,96g
mO = 2,76 – 0,14.12 – 0,12 = 0,96g
![]() %mO = 34,78%
%mO = 34,78%
Chọn D.

X C , H , O + N a O H → 1 H 2 O m u ố i m u ố i → 2 O 2 , t o N a 2 C O 3 + C O 2 + H 2 O n N a O H = 2 n N a 2 C O 3 = 0 , 06 m X + m N a O H = m m u ố i + 18 n H 2 O n H 2 O = 0 , 04 n H / X = 2 n H 2 O 1 + 2 n H 2 O 2 - n N a O H = 0 , 12 n C / X = n N a 2 C O 3 + n C O 2 = 0 , 14 % m O / X = 2 , 76 - 0 , 14 . 12 - 0 , 12 2 , 76 . 100 % = 34 , 78 % ≈ 35 %

Đáp án : D
nNa2CO3 = 0,03 mol ; nCO2 = 0,11 mol ; nH2O = 0,05 mol
Bảo toàn nguyên tố : nC(X) = nNa2CO3 + nCO2 = 0,14 mol
Và nH = 2nH2O = 0,1 mol => mO = 0,98g
( Ta có : X + NaOH chỉ tạo 2 muối => X có thể là este của phenol và Số H trong X cũng bằng số H trong muối và sản phẩm cháy )
=> %mO(X) = 35,5% gần nhất với giá trị 35%
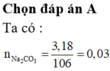
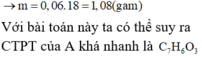
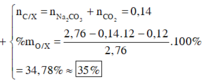
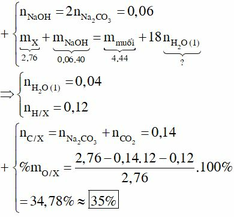
Bảo toàn Na: mol NaOH=2*mol Na2CO3 = 0.06
Bảo toàn khối lượng ==> mH2O = 2,76 + 40*0,06 - 4,44 = 0,72 ==> mol H2O = 0,04
CxHyOz + NaOH ---> muối CxHy-1O2Na + H2O (1)
----a--------0,06----------------------------------0,04
muối CxHy-1O2Na + O2 ----> CO2 + H2O + Na2CO3 (2)
------------------------------------0,11---0,05-----0,03
(1)+(2): CxHyO2Na + NaOH + O2 ----> CO2 + H2O + Na2CO3 (2)
-----------------a------------------------------0,11---0,09-----0,03
mol H: ay + 0,06 = 2*0.09 = 0,18 ===> ay = 0,12
Khi A cháy ==> mol H2O = 0,5ay = 0,06 ==> m H2O = 1,08
Theo bài ra, thu được 4,44g 2 muối + nước
\(\Rightarrow\) 2 x 76 + 0,06 x 40 = 4,44 + m(g) nước
A = CxHyO2
nC = 0,14mol; nH = 0,1 + 0,04 − 0,06 = 0,08
nO = \(\frac{2\times76-m_C-m_H}{16}\) = 0,06
\(\Rightarrow\) Công thức phân tử: C7H6O3.
Đốt cháy thu \(n_{H_2O}\) = 0,02 x 3 = 0,06 mol \(\Rightarrow\) \(m_{H_2O}\) = 0,06 x 18 = 1,08 gam.