cho 5.4 gam Al tác dụng với 100g dung dịch HCl 29,2% thu được AlCl3 và khí hidro thoát ra
a,viết phương trình phản ứng
b,tính thể tich khí hidro thoát ra
c,tính khói lượng AlCl3 tạo thành
d, tính nồng độ C% của các chất trong dung dịch thu được sau phản ứng

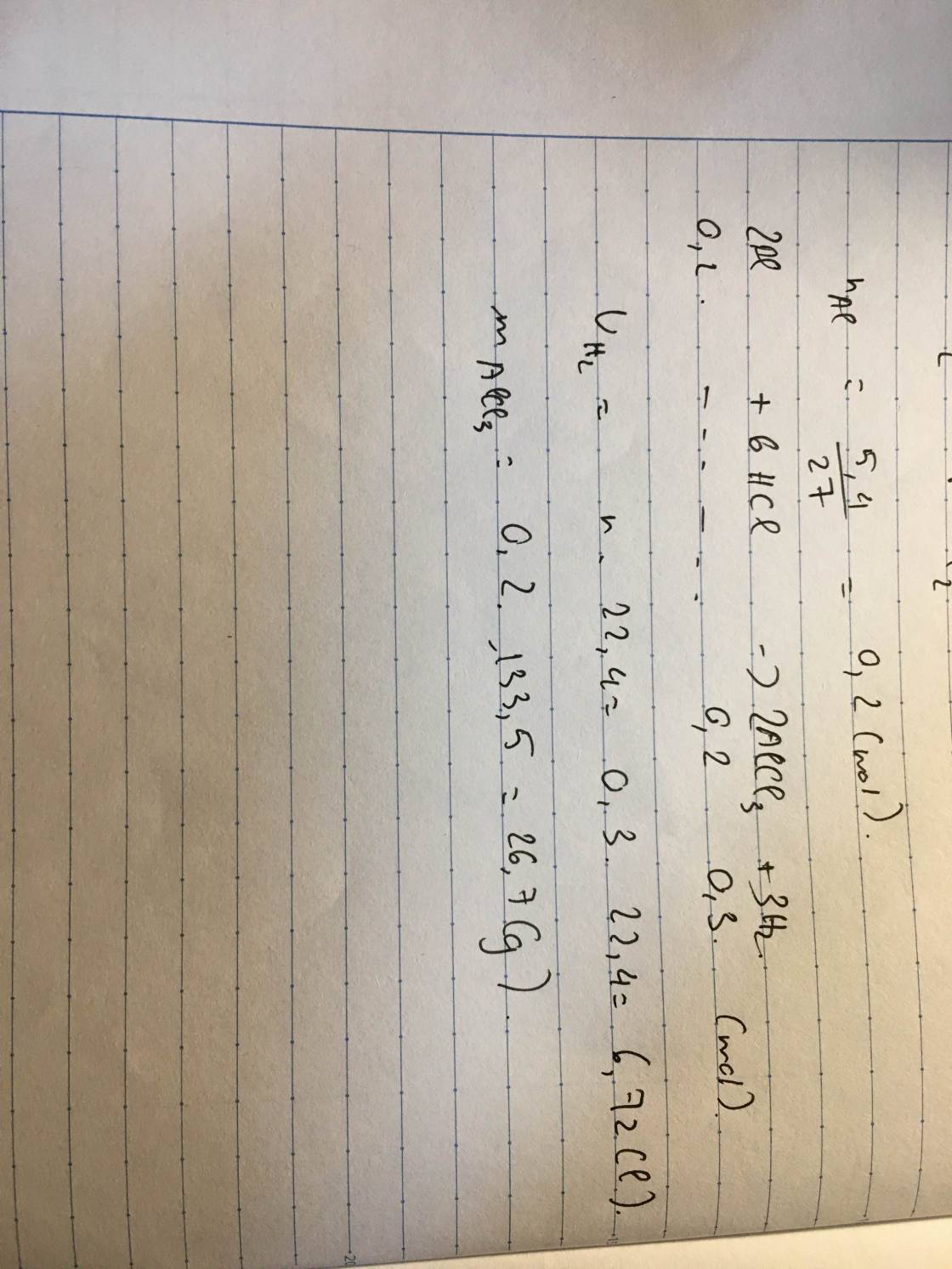
a) PTHH: 2Al + 6HCl → 2AlCl3 + 3H2 ↑
b) Số mol của Al là: 5,4 : 27 = 0,2 (mol)
Khối lượng chất tan HCl là: 100 . 29,2% = 29,2 gam
Số mol của HCl là: 29,2 : 36,5 = 0,8 mol
So sánh: \(\frac{0,2}{2}< \frac{0,8}{6}\) => HCl dư. Tính theo Al
Số mol của H2 là: 0,2 . 3/2 = 0,3 (mol)
Thể tích của H2 là: 0,3 . 22,4 = 6,72 lít
b) Số mol của AlCl3 là: 0,2 mol
Khối lượng AlCl3 tạo thành là: 0,2 . 133,5 = 26,7 gam
c) Áp dụng định luật bảo toàn khối lượng để tính khối lượng của dd sau pứ: 5,4 + 100 - ( 0,3.2) = 104,8 gam
C% của dd sau pứ = (26,7 : 104,8).100% = 25,5%