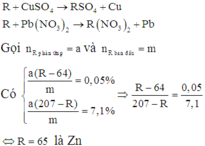a) R, X, Y là các kim loại hoá trị III, NTK tương ứng là r, x, y. nhúng hai thanh kim loại R cùng khối lượng vào hai dung dịch muối nirat của X và Y. Người ta nhận thấy khi số mol muối nitrat của R trong hai dung dịch bằng nhau thì khối lượng thanh thứ nhất giảm a% và thanh thứ hai tăng b% ( giả sử tất cả kim loại X,Y bám vào thanh R ).
Lập biểu thức tính r theo a, b, x, y.
b) áp dụng: X là Cu, Y là Pb, a = 0.2%, b = 28.4%
Lập biểu thức tính r ứng với trường hợp R là kim loại hoá trị III, X hoá trị I và Y hoá trị II, thanh thứ nhất tăng a% thanh thứ hai tăng b% các điều kiện khác như phần a).
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

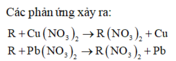
Khối lượng thanh 1 giảm do khối lượng mol của R lớn hơn Cu và khối lượng thanh 2 tăng do khối lượng mol của M nhỏ hơn Pb.
Gọi số mol R đã phản ứng ở 2 trường hợp là a.
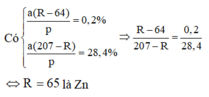
Đáp án C

$nMg + R_2(SO_4)_n \to nMgSO_4 + 2R$
Theo PTHH :
$n_R = 0,2(mol)$
$n_{Mg} = 0,1n(mol)$
Suy ra: $0,2.R - 0,1n.24 = 4$
$\Rightarrow R - 12n = 20$
Với n = 1 thì R = 32(loại)
Với n = 2 thì R = 44(loại)
Với n = 3 thì R = 56(Fe)
\(\text{TH1: Muối hoá trị 2}\\ Mg+RSO_4 \to MgSO_4+R\\ n_{Mg}=n_R=0,1(mol)\\ m_{tăng}=0,1.M_R+24.0,1=4\\ \Rightarrow M_r=64(Cu) \text{TH1: Muối hoá trị 3}\\ nMg+R_2(SO_4)_n \to nMgSO_4+2R\\ n_{Mg}=\frac{0,2}{n}(mol)\\ m_{tăng}=0,2.M_R+24.0,1.n=4\\ n=3; R=56 (Fe) \)

Câu 1:
2M+nCuSO4\(\rightarrow\)M2(SO4)n+nCu
2M+nFeSO4\(\rightarrow\)M2(SO4)n+nFe
- Gọi a là số mol của M
- Độ tăng khối lượng PTHH1:
64na/2-Ma=20 hay(32n-M).a=20
- Độ tăng khối lượng PTHH2:
56.na/2-Ma=16 hay (28n-M)a=16
Lập tỉ số ta được:\(\dfrac{32n-M}{28n-M}=\dfrac{20}{16}=1,25\)
32n-M=35n-1,25M hay 0,25M=3n hay M=12n
n=1\(\rightarrow\)M=12(loại)
n=2\(\rightarrow\)M=24(Mg)
n=3\(\rightarrow\)M=36(loại)
Câu 2:Gọi A là khối lượng thanh R ban đầu.
R+Cu(NO3)2\(\rightarrow\)R(NO3)2+Cu
R+Pb(NO3)2\(\rightarrow\)R(NO3)2+Pb
- Gọi số mol Cu(NO3)2 và Pb(NO3)2 là x mol
- Độ giảm thanh 1: \(\dfrac{\left(R-64\right)x}{A}.100=0,2\)
- Độ tăng thanh 2: \(\dfrac{\left(207-R\right)x}{A}.100=28,4\)
Lập tỉ số: \(\dfrac{207-R}{R-64}=\dfrac{28,4}{0,2}=142\)
207-R=142R-9088 hay 143R=9295 suy ra R=65(Zn)

Đáp án C
Tổng khối lượng 2 thanh kim loại sau phản ứng vẫn là 2a gam
=> mthanh 1 tăng = mthanh 2 tăng
Đặt số mol kim loại phản ứng với AgNO3 và Cu(NO3)2 lần lượt là x, y
=> 108 . 2 x - M X . x = M X . y - 64 y ( 1 )
Nồng độ mol của muối kim loại X trong dung dịch Cu(NO3)2 gấp 10 lần trong dung dịch AgNO3.
⇒ y 1 , 5 = 10 . x 0 , 1 ⇒ y = 150 x thay vào (1) được:
108 . 2 x - M X . x = M X . 150 x - 64 . 150 x ⇒ M X = 65 => X là Zn.

gọi Cthuc Oxit X là M2On : Y là : M2Om
Ta có Pt; M2On + 2nHNO3-> 2M(NO3)n+ nH2O
M2On + 2nHCl2-> 2MCln+ nH2O
- Tự chọn lượng chất: Gọi số gam oxit X là (2M+16n)gam hay 1 mol
ta có 2(M+62n)-2(M+35,5n)= 99,38( 2M+16n)/100
Gia ra:
M=18,7n
biện luân với n= 1,2,3
Nhận n=3 =>M =56
Vậy X là Fe2O3
Từ Phân tử khối của oxit Y bằng 45% phân tử khối của oxit X
=> Y: FeO