Hòa tan 1oxit kim loại hóa trị II bằng lượng vừa đủ H2SO4 10% thu được dd muối có nồng độ 11.77%. Xác định tên?
Hòa tan 1oxit kim loại hóa trị II bằng lượng vừa đủ H2SO4 10% thu được dd muối có nồng độ 11.77%. Xác định tên oxit kim loại.Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(MO+H_2SO_4->MSO_4+H_2O\\ m_{ddH_2SO_4}=100g\left(tự.chọn\right)\\ C\%_{sau}=\dfrac{11,8}{100}=\dfrac{\dfrac{100.0,1}{98}\left(M+96\right)}{\dfrac{100.0,1}{98}\left(M+16\right)+100}\\ M=24\left(Mg\right)\\ CT:MgO\)

CT oxit : MO
Đặt số mol oxit phản ứng là 1 mol
\(MO+H_2SO_4\rightarrow MSO_4+H_2O\)
\(m_{ddH_2SO_4}=\dfrac{1.98}{15,8\%}=620,25\left(g\right)\)
\(m_{ddsaupu}=620,25+M+16=M+636,25\left(g\right)\)
Ta có : \(C\%_{MSO_4}=\dfrac{M+96}{M+636,25}.100=22,959\)
=> M=65 (Zn)
=> Oxit kim loại : ZnO (Kẽm oxit)

Gọi CTHH oxit kim loại là \(RO\)
Giả sử có 1mol oxit pứ
\(RO+H_2SO_4\rightarrow RSO_4+H_2O\)
\(1-\rightarrow1---\rightarrow1\)
\(m_{ddH_2SO_4}=\dfrac{1.98}{4,9}\cdot100=2000\left(g\right)\\ m_{ddRSO_4}=1\left(R+16\right)+2000=2016+R\left(g\right)\\ C_{\%RSO_4}=\dfrac{1\left(R+96\right)}{2016+R}\cdot100=5,88\%\\ \Rightarrow R\approx24\left(g/mol\right)\)
Vậy R là Mg

Gọi CT của oxit : RO
n RO = a ( mol )
PTHH:
RO + H2SO4 ====> RSO4 + H2O
a--------a------------------a
theo pthh:
n H2SO4 = n RSO4 = n RO = a ( mol )
Có: n H2SO4=a ( mol ) => m H2SO4 = 98a ( g )
=> m dd H2SO4 20% = 490a ( g )
BTKL: m dd sau phản ứng = a ( R + 16 ) + 490a = aR + 506a ( g )
Lại có :
n RSO4 = a ( mol ) => m RSO4 = aR + 96a
=> \(\dfrac{aR+96a}{aR+506a}=\dfrac{22,64}{100}\Rightarrow\dfrac{a\left(R+96\right)}{a\left(R+506\right)}=\dfrac{22,64}{100}\)
\(\Rightarrow R=24\left(Mg\right)\)
Vậy CT: MgO

Đặt CT muối cacbonat: MCO3
Giả sử có 1 mol MCO3 phản ứng
MCO3 + H2SO4 ===> MSO4 + CO2 + H2O
1 1 1 1 1 ( mol)
<=>(M + 60) 98 (M + 96) 44 ( gam)
mdung dịch ( sau pứ)= M + 60 + 90 x 100 / 20 - 44 = ( M + 506 ) gam
Ta có: M + 96 = 0,28196 x ( M+506) => M = 65
=> M là Zn
Vậy công thức của muối cacbonat: ZnCO3

Gọi x là hóa trị của kim loại
Gỉa sử kim loại tham gia 1 mol => Ta có PTHH:
2R + xH2SO4 ---------> A2(SO4)x + xH2
1.........x\2.....................1\2.............x\2 (mol)
Ta có : mA = 1 . MA = A(g) ; mH2SO4= \(\frac{98x}{2}\) (g)
=> mddH2SO4 =\(\frac{\frac{98x}{2}.100}{9.8}\) = 500x (g)
=> mdd sau phản ứng = mH2SO4 + mA - mH2 = 500x + A - x (g)
=> mmuối sunfat= \(\frac{2A+96x}{2}\)(g)
Vậy nồng độ muối sau phản ứng là \(\frac{\frac{2A+96x}{2}}{500x+A-x}=\frac{15.14}{100}\)
=> A = \(\frac{2754.86}{84.86}\) x
Xét x = 1 thì A là 32.46358708 [ A là Lưu huỳnh (loại)]
x = 2 thì A là 64.92717417 [A là Zn ( nhận)]
x = 3 thì A là 97.39076125 (loại)
Vậy kim loại tham gia phản ứng là Kẽm (Zn)

Chọn C
Gọi công thức của oxit hóa trị II là RO
Đặt mol RO = 1 (mol)
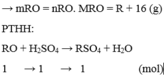
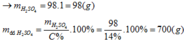
![]()
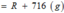
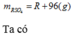

Vậy công thức của oxit kim loại là MgO

\(M+H_2SO_4\rightarrow MSO_4+H_2\uparrow\\ n_{ASO_4}=n_A=n_{H_2}=n_{H_2SO_4}=a\left(mol\right)\\ 1.m_{ddH_2SO_4}=\dfrac{98a.100}{20}=490a\left(g\right)\\ 2.m_{ddsau}=M_M.a+490a-2a=\left(M_M+488\right).a\left(g\right)\\ C\%_{ddsau}=22,64\%\\ \Leftrightarrow\dfrac{\left(M_M+96\right)a}{\left(M_M+488\right)a}.100\%=22,64\%\\ \Leftrightarrow M_M=18,72\left(loại\right)\)
Khả năng cao sai đề nhưng làm tốt a,b nha

AO + H2SO4 ---> ASO4 + H2O
1mol..1mol..........1mol
theo bảo toàn khối lượng ta có
m dd = m AO + m H2SO4
= 16 + A + 98.100/10= 996 + A(g)
m ASO4 = 96 + A
=> pt
(96 + A)/(996 + A)= 11,77%
=> A = 24 ( Mg)