phải dùng bao nhiêu lít khí nito và bao nhiêu lít khí hidro để điều chế 17g NH3 . biết rằng hiệu suất chuyển hóa thành amoniac là 25% . Các thể tích khí được đo ở đktc .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Số mol của NH3 là: nNH3(thực tế)= 17/17=1 (mol)
---> nN2 =1/2 nNH3 = 0.5 mol, nH2=3/2 nNH3=1.5 mol
Do thực tế NH3 sinh ra chỉ bằng 25% lượng NH3 có thể sinh ra. Vậy ta có:
nNH3 (100%) được sinh ra=nNH3(thực tế)*4=1*4=4mol
--> nN2( thực)= 0.5*4=2mol--> V N2 = 44,8 lít
nH2 (thực)=1,5*4 mol=6mol ---> VH2 = 134,4 lít
có pt: N2 + 3H2 = 2NH3
theo đề bài thì nNH3 =17/17=1 mol
suy ra từ phương trình thì nN2=1/2nNH3 *100/25=2 mol
vậy V N2=2*22,4=44,8 lit
va nH2=3/2 nNH3* 100/25 =6 mol
vậy V H2 =6*22,4= 134,4 lit

$n_{NH_3} = \dfrac{17}{17} = 1(mol)$
$N_2 + 3H_2 \xrightarrow{t^o} 2NH_3$
Theo PTHH :
$n_{N_2\ pư} = \dfrac{1}{2}n_{NH_3} = 0,5(mol)$
$n_{H_2\ pư} = \dfrac{3}{2}n_{NH_3} = 1,5(mol)$
Suy ra :
$n_{N_2\ đã\ dùng} = \dfrac{0,5}{25\%} = 2(mol)$
$n_{H_2\ đã\ dùng} = \dfrac{1,5}{25\%} = 6(mol)$
Vậy :
$V_{N_2} = 2.22,4 = 44,8(lít)$
$V_{H_2} = 6.22,4 = 134,4(lít)$

N2+ 3H2 ⇌ 2NH3
nNH3= 1mol
Theo phương trình: nN2 (PT)= ½.nNH3= 0,5 mol;
nH2 (PT)= 3/2. nNH3=1,5 mol
Công thức tính hiệu suất:

→nN2(thực tế)=2mol; nH2 (thực tế)= 6 mol
→ VN2(thực tế)=44,8 lít; VH2 (thực tế)= 134,4 lít
Đáp án D

- Đáp án A
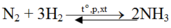
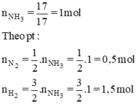
Do hiệu suất 25% nên
nN2cần dùng = 2( mol) và nH2cần dùng = 6(mol).
⇒VN2 = 2. 22,4 = 44,8 (lit) và VH2 = 22,4. 6= 134,4 (lit).

Khi hiệu suất đạt 25% thì được 67.2 lít
Theo lí thuyết sẽ là 100% hay khi đó =67,2 x 4=268.8 lit =12mol
N2 +3H2 =>2NH3
6<.......18<.......12
vN2 =6 x 22,4 =134.4lit
vH2 =1 x 22,4=403,2LIT
. 44,8 lít N2 và 134,4 lít H2
Do hiệu suất 25 % nên thể tích N2, H2 cần gấp 4 lần so với lí thuyết.
sao bn lại ra được 44,8 lít khí nito và 134,4 lít hidro ?