Khử hoàn toàn 40g hỗn hợp gồm CuO và Fe2O3 ở nhiệt độ cao dùng 15,68l khí CO (đktc). a.Xác định % khối lượng mỗi oxit b.Nếu cho hỗn hợp trên tác dụng với dung dịch H2SO4 10% thì cần dùng bao nhiêu gam dung dịch H2SO4
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
nH+ = 2nH2SO4 + nHCl = 0,1.1.2 + 0,1.1 = 0,3 mol
Ta thấy:
- Khi X + axit:
2H+ + O2- → H2O
=> nO(oxit) = 0,5nH+ = 0,15 mol
- Khi X + Chất khử:
CO + [O] → CO2
H2 + [O] → H2O
=> nO(oxit) = n(CO+H2) = 0,15 mol
=> VCO,H2 = 0,15.22,4 = 3,36 lit

Đáp án A
Phương pháp: Công thức nhanh: nO (trong oxit) = 1/2 . nH+
Hướng dẫn giải:
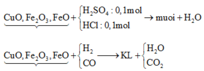
∑ nH+ = 2nH2SO4 + nHCl = 0,1.2 + 0,1 = 0,3 (mol)
=> nO (Trong oxit) = 1/ 2 nH+ = 0,15 (mol)
∑ nCO + H2 = nO (Trong oxit) = 0,15 (mol) => V = 0,15.22,4 = 3,36 (lít)

\(CuO+CO\rightarrow Cu+CO_2\)
..x...........x........x......................
\(Fe_2O_3+3CO\rightarrow2Fe+3CO_2\)
...y...........3y...........2y............
a, Ta có : \(m_{hh}=m_{CuO}+m_{Fe2O3}=80x+160y=40\)
Theo PTHH : \(n_{CO}=x+3y=\dfrac{V}{22,4}=0,7\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\) ( mol )
\(\Rightarrow m_{CuO}=n.M=8g\left(20\%\right)\)
\(\Rightarrow\%Fe_2O_3=80\%\)
b, Hòa tan hh trong dung dịch HCl dư thu được kim loại Cu .
- Lấy FeCl2 tạo thành vào dung dịch NaOH tạo Fe(OH)3 kết tủa .
- Nung kết tủa đến kl không đổi thu được Fe2O3 .
- Dẫn CO đến dư khử thu được Fe .
a) PTHH: \(Cu+CO\xrightarrow[]{t^o}Cu+CO_2\uparrow\)
a____a (mol)
\(Fe_2O_3+3CO\xrightarrow[]{t^o}2Fe+3CO_2\uparrow\)
b_____3b (mol)
Ta lập được HPT \(\left\{{}\begin{matrix}80a+160b=40\\a+3b=\dfrac{15,68}{22,4}=0,7\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,1\cdot80}{40}\cdot100\%=20\%\\\%m_{Fe_2O_3}=80\%\end{matrix}\right.\)
b) Hỗn hợp sau p/ứ gồm Đồng và Sắt
Cách tách: Đổ dd HCl dư vào hh, chất rắn không tan là Đồng
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
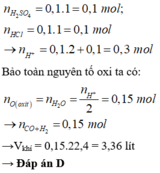

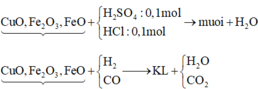
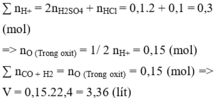

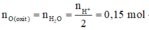
a) PTHH: \(CuO+CO\xrightarrow[]{t^o}Cu+CO_2\uparrow\)
a_____a (mol)
\(Fe_2O_3+3CO\xrightarrow[]{t^o}2Fe+3CO_2\uparrow\)
b______3b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}80a+160b=40\\a+3b=\dfrac{15,68}{22,4}=0,7\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,1\cdot80}{40}\cdot100\%=20\%\\\%m_{Fe_2O_3}=80\%\end{matrix}\right.\)
b) PTHH: \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
0,1______0,1 (mol)
\(2Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
0,2_______0,3 (mol)
Ta có: \(n_{H_2SO_4}=0,4\left(mol\right)\) \(\Rightarrow m_{ddH_2SO_4}=\dfrac{0,4\cdot98}{10\%}=392\left(g\right)\)
a)Gọi x,y lần lượt là số mol CuO, Fe2O3
Fe2O3 + 3CO → 2Fe + 3CO2
\(\left\{{}\begin{matrix}80x+160y=40\\x+3y=0,7\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
=> \(\%m_{CuO}=\dfrac{80.0,1}{40}.100=20\%\)
=> %mFe2O3 = 80%
b) \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(n_{H_2SO_4}=0,7\left(mol\right)\)
=> \(m_{ddH_2SO_4}=\dfrac{0,7.98}{10\%}=686\left(g\right)\)