cho 16g hỗn hợp X gồm 2 kim loại Bari và R (có hoá trị không đổi) tác dụng hết với nước(dư) thu được 9.10^22 phân tử H2 . Mặt khác nếu đốt cháy 16g hỗn hợp X ở trên thì cần dùng V lít O2 (đktc).
a.Tính V
b.Tìm tên kim loại R . Biết rằng với cùng lượng kim loại R trong 16g trên cho tác dụng vừa đủ HCl(dư) thì tạo ra 1,12 lít H2(đktc)

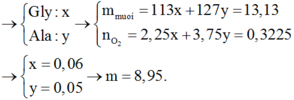
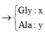
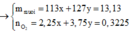
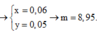

a/ \(Ba\left(a\right)+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\left(a\right)\)
\(2R\left(b\right)+2xH_2O\rightarrow2R\left(OH\right)_x+xH_2\left(0,5bx\right)\)
\(2Ba\left(a\right)+O_2\left(0,5a\right)\rightarrow2BaO\)
\(4R\left(b\right)+xO_2\left(0,25bx\right)\rightarrow2R_2O_x\)
Ta có: \(n_{H_2}=\frac{9.10^{22}}{6.10^{23}}=0,15\)
Giả sử 16g X chỉ có mình Ba thì ta có
\(n_{Ba}=\frac{16}{137}\approx0,117< 0,15=n_{H_2}\)
\(\Rightarrow\)Kim loại R cũng phản ứng với nước tạo H2
Gọi số mol của Ba, R lần lược là a, b ta có
\(n_{H_2}=a+0,5bx=0,15\left(1\right)\)
\(\Rightarrow n_{O_2}=0,5a+0,25bx=0,5\left(a+0,5bx\right)=0,5.0,15=0,075\)
\(\Rightarrow V=0,075.22,4=1,68\)
b/ \(2R\left(\frac{0,1}{x}\right)+2xHCl\rightarrow2RCl_x+xH_2\left(0,05\right)\)
Ta có: \(n_{H_2}=\frac{1,12}{22,4}=0,05\)
\(\Rightarrow b=\frac{0,1}{x}\left(2\right)\)
Ta lại có: \(137a+Rb=16\left(3\right)\)
Từ (1), (2), (3) ta có hệ pt: \(\left\{\begin{matrix}a+0,5bx=0,15\\b=\frac{0,1}{x}\\137a+Rb=16\end{matrix}\right.\)
\(\Leftrightarrow\left\{\begin{matrix}\frac{16-Rb}{137}+0,5bx=0,15\\b=\frac{0,1}{x}\\a=\frac{16-Rb}{137}\end{matrix}\right.\)
\(\Leftrightarrow\left\{\begin{matrix}\frac{16x-0,1R}{137x}+0,5.0,1=0,15\left(4\right)\\b=\frac{0,1}{x}\\a=\frac{16-Rb}{137}\end{matrix}\right.\)
\(\left(4\right)\Leftrightarrow2,3x=0,1R\Leftrightarrow R=23x\)
Thế x lần lược 1,2,3.. ta nhận x = 1, R = 23
Vậy kim loại R là Na