Nung m gam hỗn hợp X gồm kali clorat và kali pemanganat ở nhiệt độ cao có xúc tác. Sau khi các chất trong X bị phân hủy hết thu được hôn hợp Y gồm 3 chất rắn và 6,4 gam oxi. Lấy 1 phần Y đem phân tích đượ tỉ lệ số mol KCl : số mol K2MnO4=1:2. Viết PTHH của các phản ứng đã xảy ra và tính m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) \(2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\)
b)
\(n_{KClO_3} = \dfrac{36,75}{122,5} = 0,3(mol)\)
Theo PTHH :
\(n_{KCl} = n_{KClO_3} = 0,3(mol)\\ \Rightarrow m_{KCl} = 0,3.74,5 = 22,35(gam)\\ \Rightarrow m_{O_2} = m_{KClO_3} - m_{KCl} = 14,4(gam)\)
c)
Bảo toàn khối lượng :
\(m_{O_2} = 25 - 15,4 = 9,6(gam)\\ \Rightarrow n_{O_2} = \dfrac{9,6}{32} = 0,3(mol)\\ n_{KClO_3} = \dfrac{2}{3}n_{O_2} = 0,2(mol)\\ \Rightarrow m_{KClO_3} = 0,2.122,5 = 24,5(gam)\\ \%m_{tạp\ chất}= \dfrac{25-24,5}{25}.100\% = 2\%\)
\(a.\)
\(2KClO_3\underrightarrow{t^0}2KCl+3O_2\)
\(b.\)
\(n_{KClO_3}=\dfrac{36.75}{122.5}=0.3\left(mol\right)\)
\(\Rightarrow n_{O_2}=\dfrac{3}{2}n_{KClO_3}=\dfrac{3}{2}\cdot0.3=0.45\left(mol\right)\)
\(m_{O_2}=0.45\cdot32=14.4\left(g\right)\)
\(m_{KCl}=0.3\cdot74.5=22.35\left(g\right)\)
\(c.\)
\(2KClO_3\underrightarrow{t^0}2KCl+3O_2\)
\(a.............a\)
\(m_{Cr}=m_{KCl}+m_{tc}=25-122.5a+74.5a=15.4\left(g\right)\)
\(\Rightarrow a=0.2\)
\(m_{O_2}=\dfrac{3}{2}\cdot0.2\cdot32=9.6\left(g\right)\)
\(m_{KClO_3}=0.2\cdot122.5=24.5\left(g\right)\)
\(m_{tc}=25-24.5=0.5\left(g\right)\)
\(\%m_{Tc}=\dfrac{0.5}{25}\cdot100\%-2\%\)

Gọi số mol CaCO3, MgCO3 là a, b (mol)
=> 100a + 84b = 14,2 (1)
\(n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right)\)
PTHH: CaCO3 --to--> CaO + CO2
a-------------------->a
MgCO3 --to--> MgO + CO2
b---------------------->b
=> a + b = 0,15
=> a = 0,1; b = 0,05
=> \(\left\{{}\begin{matrix}\%m_{CaCO_3}=\dfrac{100.0,1}{14,2}.100\%=70,42\%\\\%m_{MgCO_3}=\dfrac{0,05.84}{14,2}.100\%=29,58\%\end{matrix}\right.\)
\(n_{CO_2}=\dfrac{6,6}{44}=0,15mol\)
\(CaCO_3\underrightarrow{t^o}CO_2+CaO\)
\(x\) \(\rightarrow\) \(x\)
\(MgCO_3\underrightarrow{t^o}MgO+CO_2\)
\(y\) \(\rightarrow\) \(y\)
\(\Rightarrow\left\{{}\begin{matrix}100x+84y=14,2\\x+y=0,15\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
\(\%m_{CaCO_3}=\dfrac{0,1\cdot100}{14,2}\cdot100\%=70,42\%\)
\(\%m_{MgCO_3}=100\%-70,42\%=29,57\%\)

Gọi a , b là số mol của KCLO3 và KMnO4
T/h 1 : Y có CO2 , N2 , O2 dư
KCLO3 ----> KCL + 3/2 O2
2 KMnO4 -----> K2MnO4 + MnO2 + O2
Gọi nO2 = x => nO2 / kk = 3x * 0,2 = 0.6x , nN2 = 3x*0.2 = 2.4x
hh khí gồm nO2 = 1.6x ; nN2 = 2.4x
Pt
C + O2 -----> CO2
nCO2 = nC = 0.528/12 = 0.044
hh khí gồm : nCO2 = 0.044 ; nO2 = 1.6x - 0.044 ; nN2 = 2.4x
=> 0.044 + 1.6x - 0.044 + 2.4x = 0.044*100 / 22.92
<=> x = 0.048
=> mmh đầu = mY + MO2 = 0.894*100 / 8.132 + 0.048* 32 = 12.53
T/h 2 : Y có CO , CO2 ; N2
Bảo toàn C : nCO + nCO2 = nC = 0.044 => nCO = 0.044 - nCO2
Bảo toàn O : 0.5*nCO + nCO2 = nO2 = 1.6a
Thay * vào đc : 0.5*( 0.044 - nCO2 ) + nCO2 = 1.6a => nCO2 = 3.2a - 0.044
Tổng mol hh : nCO + nCO2 + nN2 = 0.044 + 2.4a
=> ( 3.2a - 0.044 ) / ( 0.044 + 2.4a ) = 22.92/100
a \(\approx\)0.02
=> m = m rắn + mO2 = 0.894 *100/8.132 + 0.02 * 32 = 11.646 ( g )

Đáp án B
Từ mKCl = 0,894g => mY = 10,994g
Đặt nO2 tạo ra = x => nkk = 3x có nO2 = 0,75x và nN2 = 2,25x (mol)
, nCO2 = nC = 0,044 mol => nO2 dư = (x + 0,75x) – 0,044 (mol)
=> nT = nCO2.100/22,92 = nO2 dư + nN2 + nCO2
=> 1,75x – 0,044 + 2,25x + 0,044 = 0,192
=> x = 0,048 mol
=> m = mY + mO2 tạo ra = 12,53g
=>B


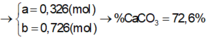
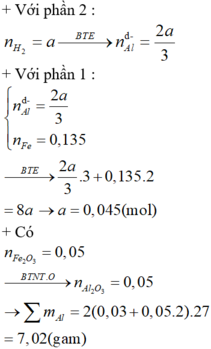
Tỷ lệ số mol của KCl: số mol của K2MnO4 = 2:1 thì mới đẹp nhé b.
\(2KClO_3\left(x\right)\rightarrow2KCl\left(x\right)+3O_2\left(1,5x\right)\)
\(2KMnO_4\left(y\right)\rightarrow K_2MnO_4\left(0,5y\right)+MnO_2\left(0,5y\right)+O_2\left(0,5y\right)\)
Gọi số mol của KClO3 và KMnO4 lần lược là x, y
\(n_{O_2}=\frac{6,4}{32}=0,2\left(mol\right)\)
\(\Rightarrow1,5x+0,5y=0,2\left(1\right)\)
Ta lại có: \(\frac{x}{0,5y}=\frac{2}{1}\)
\(\Leftrightarrow x=y\left(2\right)\)
Từ (1) và (2) ta có hệ pt: \(\left\{\begin{matrix}1,5x+0,5y=0,2\\x=y\end{matrix}\right.\)
\(\Leftrightarrow\left\{\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\Rightarrow m=0,1.122,5+0,1.158=28,05\left(g\right)\)
PS: Nếu như không giống như mình sửa thì bạn cứ làm theo như vậy vẫn được nhé. Chỉ cần thay số lại thôi.