A là dung dịch H2SO4 0,2M, B là dung dịch H2SO4 0,5M. Trộn A và B theo tỉ lệ thể tích VA : VB = 2:3 được dung dich C.
a) Xác đinh Nồng độ mol của C
b) Phải trộn A và B theo tỉ lệ thể tích như thế nào để được dung dịch H2SO4 0,3M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
Coi V A = 2(lít) => V B = 3(lít)
Trong dung dịch C, ta có :
V C = V A + V B = 2 + 3 = 5(lít)
n H2SO4 = n H2SO4(trong A) + n H2SO4(trong B) = 2.0,2 + 3.0,5 = 1,9(mol)
Suy ra :
CM H2SO4 = 1,9/5 = 0,38M
b)
Sau khi trộn :
V C = V A + V B
n H2SO4 = 0,2V A + 0,5V B
Suy ra :
CM H2SO4 = (0,2V A + 0,5V B)/(V A + V B ) = 0,3
<=> 0,2V A + 0,5V B = 0,3V A + 0,3V B
<=> 0,1V A = 0,2V B
<=> V A / V B = 0,2/0,1 = 2 / 1
Vậy phải trộn A và B theo tỉ lệ 2 : 1 về thể tích
\(GS:\)
\(V_A=2\left(l\right),V_B=3\left(l\right)\)
\(n_{H_2SO_4\left(1\right)}=0.2\cdot2=0.4\left(mol\right)\)
\(n_{H_2SO_4\left(2\right)}=0.5\cdot3=1.5\left(mol\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.4+1.5}{2+3}=0.38\left(M\right)\)
\(b.\)
\(V_{H_2SO_4\left(1\right)}=a\left(l\right)\)
\(V_{H_2SO_4\left(2\right)}=b\left(l\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.2a+0.5b}{a+b}=0.3\left(M\right)\)
\(\Leftrightarrow0.2a+0.5b-0.3a-0.3b=0\)
\(\Leftrightarrow0.2b=0.1a\)
\(\Leftrightarrow\dfrac{a}{b}=\dfrac{0.2}{0.1}=2\)

Ta có: V A : V B = 2:3
Số mol H 2 S O 4 có trong 2V (l) dung dịch A:
n H 2 S O 4 = C M . V A = 0,2 . 2V = 0,4V (mol)
Số mol H 2 S O 4 có trong 3V (l) dung dịch B:
n H 2 S O 4 = C M . V B = 0,5 . 3V = 1,5V (mol)
Nồng độ mol của dung dịch H 2 S O 4 sau khi pha trộn:
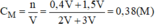
Vậy nồng độ mol của dung dịch C là 0,38M.

\(a) V_A = 2(lít) \to V_B = 3(lít)\\ \Rightarrow V_{dd} = 2 + 3 = 5(lít)\\ n_{H_2SO_4\ trong\ C} = 0,2.2 + 0,5.3 = 1,9(mol)\\ C_{M_{H_2SO_4}} = \dfrac{1,9}{5} = 0,38M\)

Pha chế dung dịch H 2 S O 4 0,3M.
Gọi x(l) là thể tích của dung dịch axit A.
y(l) là thể tích của dung dịch B.
n H 2 S O 4 ( A ) = C M . V A = 0,2 . x (mol)
n H 2 S O 4 ( B ) = C M . V B = 0,5 . y (mol)
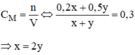
Vậy: ta phải trộn 2 thể tích dung dịch axit A với 1 thể tích dung dịch axit B, ta sẽ được dung dịch H 2 S O 4 có C M = 0,3M.

a) Ta có: VA:VB = 2:3
Số mol H2SO4 có trong 2V dung dịch A:
Số mol H2SO4 có trong 3V dung dịch B:
Nồng độ mol của dung dịch H2SO4 sau khi pha trộn:
Vậy nồng độ mol của dung dịch C là 0,38M.
b) Pha chế dung dịch H2SO4 0,3M.
Gọi x(ml) là thể tích của dung dịch axit A.
y(ml) là thể tích của dung dịch B.
→ x = 2y . Vậy nêu y = 1 và x = 2.
Vậy ta phải trộn 2 thể tích dung dịch axit A với 1 thể tích dung dịch axit B, ta sẽ được dung dịch H2SO4 có CM = 0,3M.

Gọi \(\left\{{}\begin{matrix}C_{M\left(A\right)}=aM\\C_{M\left(B\right)}=bM\end{matrix}\right.\)
Giả sử trộn 50ml dd A với 50ml dd B để thu được 100ml dd C
=> \(\left\{{}\begin{matrix}n_{NaOH}=0,05a\left(mol\right)\\n_{Ba\left(OH\right)_2}=0,05b\left(mol\right)\end{matrix}\right.\)
\(n_{BaSO_4}=\dfrac{9,32}{233}=0,04\left(mol\right)\)
nH2SO4 = 0,035.2 = 0,07 (mol)
PTHH: Ba(OH)2 + H2SO4 --> BaSO4 + 2H2O
0,04<----0,04<-------0,04
2NaOH + H2SO4 --> Na2SO4 + 2H2O
0,06<----0,03
=> \(\left\{{}\begin{matrix}0,05a=0,06\\0,05b=0,04\end{matrix}\right.\)
=> a = 1,2; b = 0,8
20 ml dd A chứa nNaOH = 0,02.1,2 = 0,024 (mol)
\(n_{Al_2O_3}=\dfrac{20,4}{102}=0,2\left(mol\right)\)
PTHH: 2NaOH + Al2O3 --> 2NaAlO2 + H2O
0,024-->0,012
Ba(OH)2 + Al2O3 --> Ba(AlO2)2 + H2O
0,188<---0,188
=> \(V_{dd.B}=\dfrac{0,188}{0,8}=0,235\left(l\right)=235\left(ml\right)\)
a/ Theo quy tắc đường chéo ta có:
\(\dfrac{2}{3}=\dfrac{0,5-C_{MC}}{C_{MC}-0,2}\)
\(\Leftrightarrow C_{MC}=0,38\left(M\right)\)
b/ Theo quy tắc đường chéo ta có:
\(\dfrac{V_A}{V_B}=\dfrac{0,5-0,3}{0,3-0,2}=2\)
0.5 -Cmc/ Cmc-0.2 là sao vậy ạ ?