Hoà tan hoàn toàn 20,88 g 1 oxit FexOy bằng dung dịch H2SO4 đặc, nóng, dư thu được dung dịch X và 3,248 lít khí SO2( sản phẩm khử duy nhất, đktc). Xác định công thức phân tử của FexOy và tính khối lượng muối trung hòa có trong X.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
Quy đổi oxit sắt thành hỗn hợp của Fe và O.
Vì chất rắn ban đầu đem hòa tan trong dung dịch H2SO4 đặc nóng là oxit sắt nên số oxi hóa của sắt trong hợp chất ban đầu nhỏ nhất là +2. Mặt khác, phản ứng tạo thành SO2 nên đây là phản ứng oxi hóa - khử. Do đó số oxi hóa của sắt tăng lên trong hợp chất cuối cùng thành +3.


Coi oxit sắt là Fe và O có số mol lần lượt là x và y (mol)
nSO2 = 0,145 (mol)
Qúa trình nhường e
Fe -3e → Fe3+
x 3x (mol)
Quá trình nhận e
O + 2e → O-2
y 2y (mol)
S +6 +2e → SO2
0,29 ← 0,145 (mol)
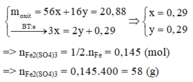
Đáp án A

Có nSO2 = 0,225 mol
Coi hỗn hợp gồm x mol Fe; y mol O ; z mol Cu.
Cho X vào H2SO4 thì có quá trình:
+ Cho e : Fe → Fe+3 + 3e
Cu → Cu2+ + 2e
+ Nhận e: S+6 + 2e → S+4
O + 2e → O-2
Theo DLBT e có: 3x + 2z = 2.0,0225 + 2y mX= 56x + 16y +64z=2,44
m muối = mFe2(SO4)3 + mCuSO4 = 200x + 160z= 6,6
Giải hệ ta được z= 0,01mol => mCu(X)= 0,64g => m(FexOy)=1,8g
=>%mFexOy= 73,77%
=>B
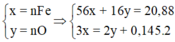
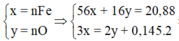
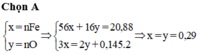


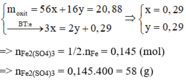



Coi oxit gồm $Fe(x\ mol) ; O(y\ mol)$
Ta có : 56x + 16y = 20,88(1)$
$n_{SO_2} = 0,145(mol)$
Bảo toàn electron : $3x = 2y + 0,145.2(2)$
Từ (1)(2) suy ra x = 0,29 ; y = 0,29$
$n_{Fe} : n_O = 0,29 : 0,29 = 1 : 1$
Do đó, oxit là $FeO$
$n_{Fe_2(SO_4)_3} = \dfrac{1}{2}n_{Fe} = 0,145(mol)$
$m_{Fe_2(SO_4)_3} = 0,145.400 = 58(gam)$