Hòa tan hoàn toàn 280 lít khí hidro clorua (đo ở đktc) vào 1 lít nước, thu được dung dịch A. Nồng độ phần trăm của chất tan trong A là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)Gọi A là kim loại cần tìm.
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05mol\)
Ta có PTHH:
\(2A+2H_2O\rightarrow2AOH+H_2\uparrow\)
0,1-----------------0,1--------0,05-----(mol);
Vậy \(M_A=\dfrac{2,3}{0,1}=23\)(g/mol) => A là Na
b) Ta có: \(m_{dd}=2,3+57,8-0,05\cdot2=60g\)
Từ đó suy ra:\(\%C_{NaOH}=\dfrac{0,1\cdot40}{60}\cdot100\%=6,67\%\)

nHCl = 0.3*0.75 = 0.225 (mol)
Zn + 2HCl => ZnCl2 + H2
0.1125..0.225....0.1125..0.1125
mZn = 0.1125*65 = 7.3125 (g)
VH2 = 0.1125*22.4 = 2.52 (l)
CM ZnCl2 = 0.1125/0.3 = 0.375 (M)
nHCl= 0,75 x 0,3= 0,225(mol)
PTHH: Zn + 2HCl -> ZnCl2 + H2
a) 0,1125____0,225___0,1125___0,1125(mol)
=> a=mZn=0,1125.65=7,3125(g)
V(H2,đktc)=0,1125 x 22,4=2,52(l)
b) VddZnCl2=VddHCl=0,3(l)
=>CMddZnCl2=0,1125/0,3=0,375(M)

a) \(n_{Al}=\dfrac{8,64}{27}=0,32\left(mol\right)\)
\(n_{HCl}=\dfrac{365.10\%}{36,5}=1\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
Xét tỉ lệ \(\dfrac{0,32}{2}< \dfrac{1}{6}\) => Al hết, HCl dư
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,32-->0,96---->0,32--->0,48
=> \(V_{H_2}=0,48.22,4=10,752\left(l\right)\)
b) Trong Y chứa AlCl3 và HCl dư
\(m_{AlCl_3}=0,32.133,5=42,72\left(g\right)\)
c) mdd sau pư = 8,64 + 365 - 0,48.2 = 372,68 (g)
\(\left\{{}\begin{matrix}C\%\left(AlCl_3\right)=\dfrac{42,72}{372,68}.100\%=11,463\%\\C\%\left(HCldư\right)=\dfrac{\left(1-0,96\right).36,5}{372,68}.100\%=0,392\%\end{matrix}\right.\)

\(n_{H_2S}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\\\rightarrow m_{H_2S}=0,75.34=25,5\left(g\right)\\ m_{dd}=25,5+174,5=200\left(g\right)\\ \rightarrow C\%_{H_2S}=\dfrac{25,5}{200}.100\%=12,75\%\)

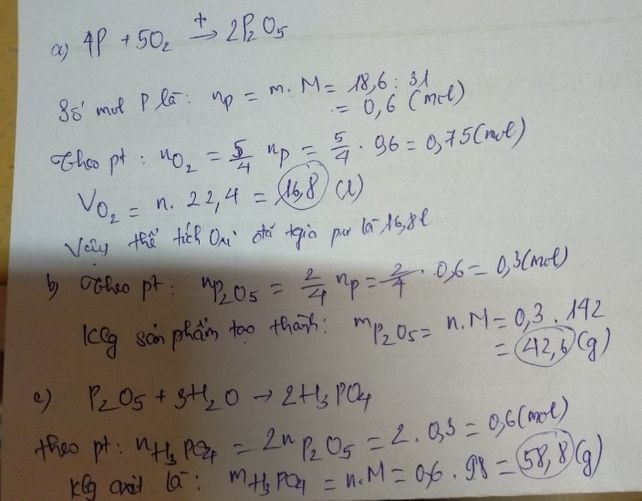
 Bạn tham khảo cách làm nhé! cho mik 1 like nha
Bạn tham khảo cách làm nhé! cho mik 1 like nha
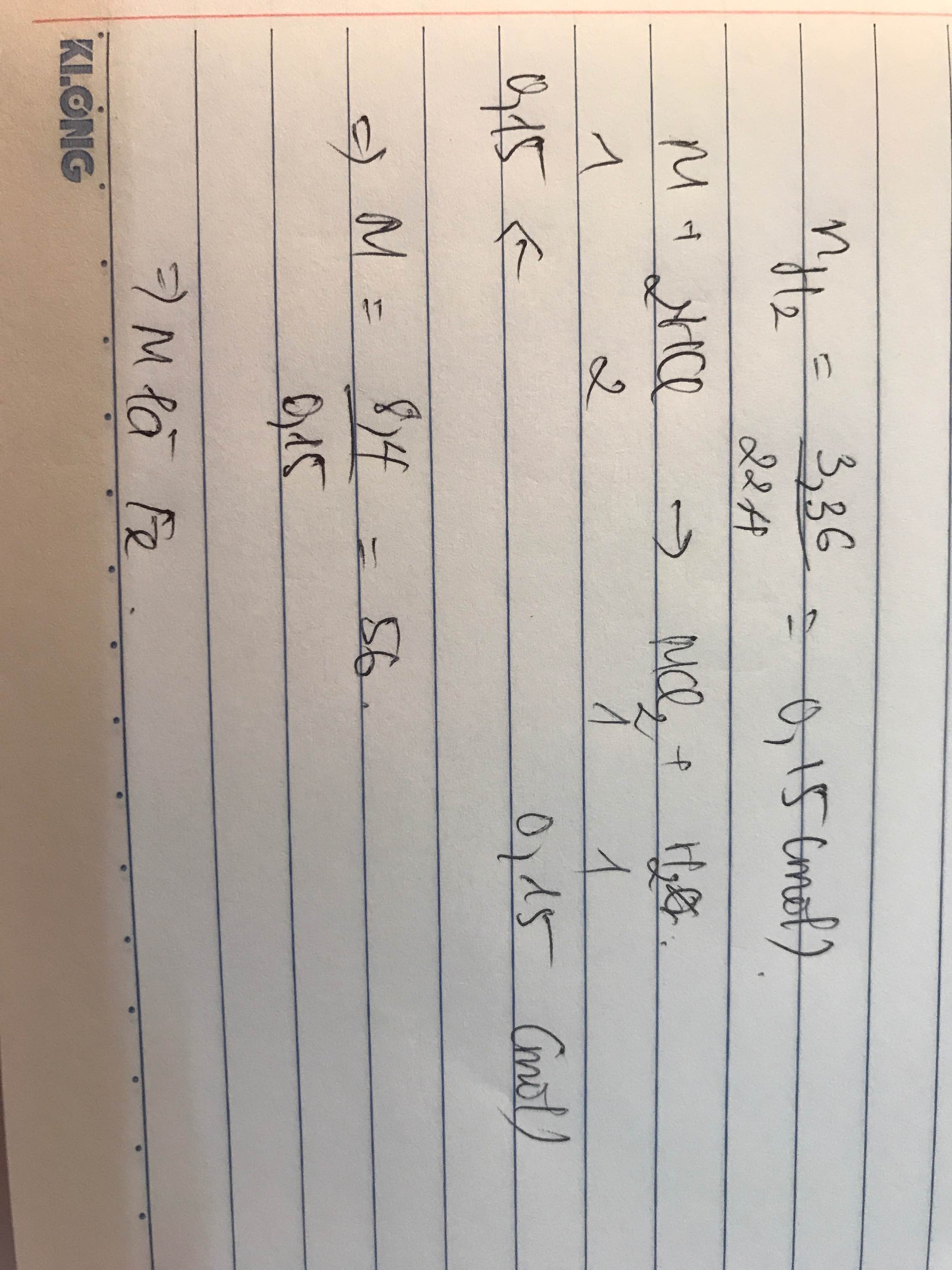
V = 1 l = 1000 ml
nHCl = \(\frac{280}{22,4}=12,5\left(mol\right)\)
=> A : HCl
CM HCl = \(\frac{12,5}{1000}=0,0125\left(M\right)\)