9. Trong công nghiệp điều chế H2SO4 từ FeS2 theo sơ đồ sau: FeS2 SO2 SO3 H2SO4 a) Viết phương trình phản ứng và ghi rõ điều kiện. b) Tính lượng axit H2SO4 điều chế được từ 1 tấn quặng chứa 60% FeS2. Biết H% của quá trình là 80%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a)
\(4FeS_2 + 11O_2 \xrightarrow{t^o} 2Fe_2O_3 + 4SO_2\\ 2SO_2 + O_2 \xrightarrow{t^o,V_2O_5} 2SO_3\\ SO_3 + H_2O \to H_2SO_4\)
b)
\(m_{FeS_2} = 1000.60\% = 600(kg)\\ n_{FeS_2} = \dfrac{600}{120} = 5(kmol)\\ \Rightarrow n_{FeS_2\ pư} = 5.80\% = 4(kmol)\)
Bảo toàn nguyên tố với S : \(n_{H_2SO_4} = 2n_{FeS_2} = 4.2 = 8(kmol)\)
Suy ra :
\(m_{H_2SO_4} = 8.98 = 784(kg)\\ \Rightarrow m_{dd\ H_2SO_4} = \dfrac{784}{98\%} =800(kg)\)

\(m_{FeS_2}=0.6\left(tấn\right)=0.6\cdot10^3\left(kg\right)\)
\(n_{FeS_2}=\dfrac{0.6\cdot10^3}{120}=\dfrac{10^3}{200}\left(kmol\right)\)
Dựa vào sơ đồ phản ứng :
\(n_{H_2SO_4}=2n_{FeS_2}=2\cdot\dfrac{10^3}{200}=\dfrac{10^3}{100}=10\left(kmol\right)\)
\(m_{H_2SO_4\left(tt\right)}=10\cdot\dfrac{98}{80\%}=1225\left(kg\right)\)
\(m_{dd_{H_2SO_4}}=\dfrac{1225}{98\%}=1250\left(kg\right)=12.5\left(tấn\right)\)
\(m_{FeS_2}=\dfrac{1.60}{100}=0,6\left(tấn\right)\)
=> \(m_{FeS_2\left(pư\right)}=\dfrac{0,6.80}{100}=0,48\left(tấn\right)\)
Cứ 1 mol FeS2 điều chế được 2 mol H2SO4
=> 120g FeS2 điều chế được 196g H2SO4
=> 0,48 tấn FeS2 điều chế được 0,784 tấn H2SO4
=> \(m_{ddH_2SO_4}=\dfrac{0,784.100}{98}=0,8\left(tấn\right)\)

4FeS2 + 11O2\(\underrightarrow{t^o}\) 2Fe2O3 + 8SO2
2SO2 + O2 \(\xrightarrow[V_2O_5]{t^o}\) 2SO3
SO3 + H2O \(\rightarrow\) H2SO4
4FeS2 + 11O2 ---------> 2Fe2O3+ 8SO2(Đk: to)
2SO2 +O2---------->2SO3(Đk: xúc tác V2O5, >450oC)
SO3+ H2O ------->H2SO4

Đáp án A.
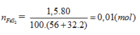
FeS2 → 2H2SO4 (Bảo toàn S)
0,01 → 0,02 (mol)
Do hiệu suất là 80%
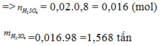

Đáp án C.
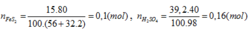
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%

mFeS2 = 1.\(\dfrac{80}{100}\) = 0,8 tấn
nFeS2 = \(\dfrac{0,8}{120}\) = \(\dfrac{1}{150}\) mol/ tấn
2FeS2 + \(\dfrac{11}{2}\)O2 \(^{to}\rightarrow\) Fe2O3 + 4SO2 \(\uparrow\)
\(\dfrac{1}{150}\)-------------------------->\(\dfrac{1}{75}\)
- do H = 90% => nSO2(thực tế) = \(\dfrac{1}{75}.\dfrac{90}{100}\) = 0,012mol/tấn
2SO2 + O2 \(^{to}\rightarrow\) 2SO3
0,012------------>0,012
- do H = 64 % => nSO3(thực tế) = 0,012. \(\dfrac{64}{100}\) = 0,00768 mol/ tấn
SO3 + H2O -> H2SO4
0,00768------->0,00768
- do H = 80 % => nH2SO4 = 0,00768 . 80% = 0,006144 mol/tấn
=> mH2SO4 = 0,006144 . 98 = 0,602112 tấn = 602,112 kg
=>mH2SO4(72%) = 602,112 . 72% = 433,52064 kg


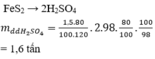
a)
$4FeS_2 + 11O_2 \xrightarrow{t^o} 2Fe_2O_3 + 8SO_2$
$2SO_2 + O_2 \xrightarrow{t^o,xt} 2SO_3$
$SO_3 + H_2O \to H_2SO_4$
b)
$m_{FeS_2} = 1000.60\% = 600(kg)$
$n_{FeS_2} = \dfrac{600}{120} = 5(kmol)$
$n_{FeS_2\ pư} = 5.80\% = 4(kmol)$
$n_{H_2SO_4} = 2n_{FeS_2} = 8(kmol)$
$m_{H_2SO_4} = 8.98 = 784(kg)$
4FeS2+11O2to→2Fe2O3+8SO2
4FeS2+11O2→to2Fe2O3+8SO2
2SO2+O2to,xt−−→2SO3
2SO2+O2→to,xt2SO3
SO3+H2O→H2SO4
SO3+H2O→H2SO4
b)
mFeS2=1000.60%=600(kg)
mFeS2=1000.60%=600(kg)
nFeS2=600120=5(kmol)
nFeS2=600120=5(kmol)
nFeS2 pư=5.80%=4(kmol)
nFeS2 pư=5.80%=4(kmol)
nH2SO4=2nFeS2=8(kmol)
nH2SO4=2nFeS2=8(kmol)
mH2SO4=8.98=784(kg)