16g hỗn hợp gồm Fe2O3 và MgO đc hòa tan hết = 300ml axit HCl. Sau PƯ cần trung hòa lượng axit dư = 50g dd Ca(OH)2 14,8% sau đó đem đun cạn dd nhận đc 46,35g muối khan. Tính % klg mỗi oxit trong hỗn hợp và nồng độ mol của axit HCl
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Fe2O3 + 6HCl →2FeCl3 + 3H2O (1)
MgO + 2HCl →MgCl2 + H2O (2)
Ca(OH)2 + 2HCl →CaCl2 + 2H2O (3)
nCa(OH)2=\(\frac{\text{50.14,8%}}{74}\)=0,1(mol)
Theo PTHH 3 ta có:
nCa(OH)2=nCaCl2=0,1(mol)
2nCa(OH)2=nHCl=0,2(mol)
mCaCl2=111.0,1=11,1(g)
mmuối của Mg,Fe=46,35-11,1=35,25(g)
Đặt nFe2O3=a ; nMgO=b
Ta có:
\(\left\{{}\begin{matrix}\text{160a+40b=16}\\\text{325a+95b=35,25}\end{matrix}\right.\)
=>a=0,05;b=0,2
mFe2O3=160.0,05=8(g)
%mFe2O3=816.100%=50%816.100%=50%
%mMgO=100-50=50%
Từ 1 ta có:
6nFe2O3=nHCl(1)=0,3(mol)
2nMgO=nHCl=0,2(mol)
=>∑nHCl=0,3+0,2+0,2=0,7(mol)
CM dd HCl=0,7/0,3=7/3M

mCa(OH)2 = 7.4 g
nCa(OH)2 = 0.1 mol
Ca(OH)2 + 2HCl --> CaCl2 + 2H2O
0.1________________0.1
mCaCl2 = 0.1*111 = 11.1 g
=> mM còn lại = 46.35 - 11.1 = 35.25 g
Đặt :
nFe2O3 = x mol
nMgO = y mol
<=> 160x + 40y = 16 (1)
Fe2O3 + 6HCl --> 2FeCl3 + 3H2O
x_________________2x
MgO + 2HCl --> MgCl2 + H2O
y_______________y
<=> 325x + 95y = 35.25 (2)
(1) và (2) :
x =0.05
y = 0.2
mFe2O3 = 8 g
mMgO = 8 g
%Fe2O3 = %MgO = 8/16*100% = 50%
PTHH: Fe2O3 + 6HCl ---> 2FeCl3 + 3H2O
Mol: x 6x 2x 3x
MgO + 2HCl ---> MgCl2 + H2O
Mol: y 2y y y
2HCl + Ca(OH)2 ---> H2O + CaCl2
Mol: 0,2 0,1 0,1 0,1
mCa(OH)2 = 14,8%*50 / 100% = 7,4g
nCa(OH)2 = 7,4 / 74 = 0,1 mol
Gọi x, y là số mol của Fe2O3, MgO
mhh = 160x + 40y = 16 (1)
mmuối = 162,5 * 2x + 95y = 35,25 (2)
Giải pt (1), (2) ==> x = 0,05 y = 0,2
%mFe2O3 = 160*0,05*100%/ 16 = 50%
%mMgO = 100% - 50% = 50%

m Ca(OH)2 = (C%.mdd)/100% = (14,8*50)/100 = 7,4 g.
=> n = m/M = 7,4 / 74 = 0,1 mol.
gọi nFe2O3 = x; nMgO = y
Fe2O3 + 6HCl -> 2FeCl3 + 3H20
__x______6x______2x
MgO + 2HCl -> MgCl2 + H2O
_y_____2y______y
Ca(OH)2 + 2HCl -> CaCl2 + 2H2O
_0.1_______0.2_____0.1
m CaCl2 = n.M = 0,1 . 111 = 11,1 g.
Muối khan thu được gồm CaCl2, FeCl3 và MgCl2.
Ta có hệ pt:
160x + 40y = 16
162,5 . 2x + 95y = 35,2 (m muối khan FeCl3 và MgCl2)
Giải hệ, được: x = 0,05; y = 0,2.
m Fe2O3 = n.M = 0,05 . 160 = 8 g.
=> %Fe2O3 = (mFe2O3 / mhh) . 100% = (8/16).100% = 50%.
=> %MgO = 100% - 50% = 50%.

a) MgO + 2HCl → MgCl2 + H2O (1)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
\(n_{Ca\left(OH\right)_2}=\frac{14,8\%.50}{40+17.2}=0,1\left(mol\right)\)
2HCldư + Ca(OH)2 → CaCl2 + 2H2O
0,2 0,1 0,1
\(m_{CaCl_2}=0,1.\left(40+35,5.2\right)=11,1\left(g\right)\)
⇒\(m_{FeCl_3}\) \(_{và}\) \(_{MgCl_2}\) = \(46,35-11,1=35,25\left(g\right)\)
gọi x, y lần lượt là số mol của Fe2O3 và MgO
theo pthh (1) và (2) thì
\(n_{MgCl_2}=n_{MgO}=y\)
\(n_{FeCl_3}=2n_{Fe_2O_3}=2x\)
ta có phương trình \(\left\{{}\begin{matrix}160x+40y=16\\325x+95y=35,25\end{matrix}\right.\)
⇒ x = 0,05; y = 0,2
⇒ \(\%m_{Fe_2O_3}=\frac{0,05.160}{16}.100=50\%\)
⇒ \(\%m_{MgO}=50\%\)
b) nHCl = 6x + 2y + 0,2 = 0,9 (mol)
⇒ C%HCl = \(\frac{0,9}{0,3}=3\left(M\right)\)
\(n_{Fe_2O_3}=x;n_{MgO}=y\\ PTHH:Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2\\ PTHH:MgO+2HCl\rightarrow MgCl_2+H_2O\\PTHH:2HCl+Ca\left(OH\right)_2\rightarrow CaCl_2+2H_2O\\ \)
\(n_{Ca\left(OH\right)_2}=\frac{50.14,8}{100.74}=0,1\left(mol\right)\\ \rightarrow n_{HCl.du}=0,1.2=0,2\left(mol\right)\\ \rightarrow m_{CaCl_2}=0,1.111=11,1\left(g\right)\\ \rightarrow325x+95y+11,1=46,35\\ \Leftrightarrow325x+95y=46,35-11,1=35,25\)
\(hpt:\left\{{}\begin{matrix}160x+40y=16\\325x+95y=35,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,05\\y=0,2\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{Fe_2O_3}=\frac{160.0,05}{16}.100\%=50\%\\\%m_{MgO}=100-50=50\%\\\sum n_{HCl}=6x+2y+0,2=0,9\left(mol\right)\rightarrow C_M=\frac{0,9}{0,3}=3\left(M\right)\end{matrix}\right.\)

Ở phần b, nếu trong hỗn hợp đầu thì phải là % khối lượng mỗi oxit chứ nhỉ? Và ở phần c phải là 1,1 g/ml chứ không phải g/mol bạn nhé!


Bạn tham khảo link nhé!
một hỗn hợp gồm Fe2O3 và MgO nặng 16g được hòa tan hết trong udng dịch axit HCL sau đó đem cô cạn dung dịch thu được 35,25g muối khan a) viết các PTHH b) tính thành phần % khối lượng mỗi oxit trong hỗn hợp ban đầu >< giúp với ạ - Hoc24

a) Fe2O3+6HCl--->2FeCl3+3H2O
x---------------------------2x(mol)
MgO+2HCl-->MgCl2+H2O
y-----------------y(mol)
b) Gọi n Fe2O3=x, n MgO=y
theo bài ra ta có hpt
\(\left\{{}\begin{matrix}160x+40y=16\\325x+95y=35,32\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,05\\y=0,2\end{matrix}\right.\)
%m Fe2O3=0,05.160/16.100%=50%
%m MgO=100-50=50%
a) Fe2O3+6HCl--->2FeCl3+3H2O
x---------------------------2x(mol)
MgO+2HCl-->MgCl2+H2O
y-----------------y(mol)
b) Gọi n Fe2O3=x, n MgO=y theo bài ra ta có :
{ 160x + 40y = 16 325x + 95y = 35, 32
{ x = 0, 05 y = 0, 2
%mFe2o3=0,05.160/16.100%=50%
%mMgO=100-50=50%
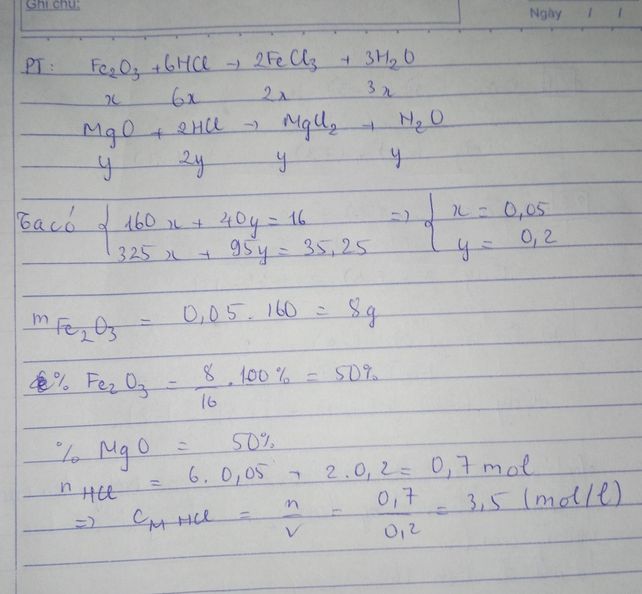
Fe2O3 + 6HCl \(\rightarrow\)2FeCl3 + 3H2O (1)
MgO + 2HCl \(\rightarrow\)MgCl2 + H2O (2)
Ca(OH)2 + 2HCl \(\rightarrow\)CaCl2 + 2H2O (3)
nCa(OH)2=\(\dfrac{50.14,8\%}{74}=0,1\left(mol\right)\)
Theo PTHH 3 ta có:
nCa(OH)2=nCaCl2=0,1(mol)
2nCa(OH)2=nHCl=0,2(mol)
mCaCl2=111.0,1=11,1(g)
mmuối của Mg,Fe=46,35-11,1=35,25(g)
Đặt nFe2O3=a
nMgO=b
Ta có:
\(\left\{{}\begin{matrix}160a+40b=16\\325a+95b=35,25\end{matrix}\right.\)
=>a=0,05;b=0,2
mFe2O3=160.0,05=8(g)
%mFe2O3=\(\dfrac{8}{16}.100\%=50\%\)
%mMgO=100-50=50%
Từ 1 ta có:
6nFe2O3=nHCl(1)=0,3(mol)
2nMgO=nHCl=0,2(mol)
=>\(\sum\)nHCl=0,3+0,2+0,2=0,7(mol)
CM dd HCl=\(\dfrac{0,7}{0,3}=\dfrac{7}{3}M\)
nHCl = 6x + 2y + 0,2 =6.0,05 + 2.0,2 + 0,2 = 0,9 mol
CM HCl = 0,9 : 0,3 = 3M