Hoàn toàn m gam hỗn hợp x gồm FeO, Fe 2 O 3 Fe 3 0 4 bằng 350 gam dung dịch HCl 14,6% thu
được dung dịch Y. Để trung hòa lượng axit dư trong Y cần dùng 140 ml dung dịch KOH 2M. Mặt
khác, để khử hoàn toàn a gam X thành kim loại cần tối thiểu V (lít) khí CO ở đktc. Tìm giá trị của V
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
![]()
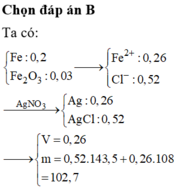
Cần dung tối thiểu => Dung dịch chỉ chứa muối F e C l 2
+ Bảo toàn Fe ![]() = 0,26 mol
= 0,26 mol
Ta có ![]()
Ta có ![]()
⇒ m k ế t t ủ a = 0,52.143,5 + 0,26.108 = 102,7 gam
Ta có ![]()
![]()

| GIẢI THÍCH THÊM |
| Từ số mol Fe và Fe2O3 nhân thấy dung dịch cuối cùng chỉ chứa FeCl2. Từ đó dùng BTNT và BTE sẽ có ngay kết quả của bài toàn. |

Chọn B
nFe = 0,2 mol
nFe2O3 = 0,03 mol
nFe = 0,26 mol
Do cần dùng tối thiểu HCl nên tạo thành Fe2+
BTĐT: nCl- = 2nFe2+ = 0,52 mol
Dd Y gồm: 0,52 mol Cl-; 0,26 mol Fe2+
Ag+ + Cl- → AgCl
Ag+ + Fe2+ → Fe3+ + Ag
m↓ = mAgCl + mAg = 0,52.143,5+0,26.108 = 102,7 gam
V = 0,52/2 = 0,26 lít = 260ml

Đáp án B
n(Fe) = 0,2 ; n(Fe2O3) = 0,03
Y gồm: FeCl2
Kết tủa gồm Ag, AgCl
Fe2O3 +6HCl → 2FeCl3 + 3H2O
0,03-----0,18------0,06
Fe+ 2FeCl3 → 3FeCl2
0,03--0,06------0,09
Fe +2HCl → FeCl2 +H2
0,17---0,34--0,17
Vậy: FeCl2: 0,09 + 0,17 = 0,26, n(HCl) cần dùng =0,18 + 0,34 = 0,52
Kết tủa: Ag (0,26) , AgCl (0,26 . 2 = 0,52)
Vậy m = 0,26 . 108 + 0,52. 143,5 = 102, 7g
V= 0,52 / 2 = 0,26 (l)

nFe = 0,2 mol
nFe2O3 = 0,03 mol
nFe = 0,26 mol
Do cần dùng tối thiểu HCl nên tạo thành Fe2+
BTĐT: nCl- = 2nFe2+ = 0,52 mol
Dd Y gồm: 0,52 mol Cl-; 0,26 mol Fe2+
Ag+ + Cl- → AgCl
Ag+ + Fe2+ → Fe3+ + Ag
m↓ = mAgCl + mAg = 0,52.143,5+0,26.108 = 102,7 gam
V = 0,52/2 = 0,26 lít = 260ml
Đáp án B

Đáp án D
Theo giả thiết, ta có :

Quy đổi hỗn hợp X thành Fe và O. Theo bảo toàn khối lượng, bảo toàn electron, bảo toàn điện tích cho dung dịch Z và bảo toàn nguyên tố N, Fe, ta có :
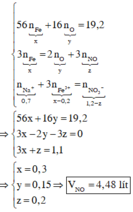

Đáp án B
Vì ![]()
Cần dung tối thiểu => Dung dịch chỉ chứa muối F e C l 2
+ Bảo toàn
Fe ![]()
Ta có :
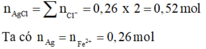
![]()
Ta có : ![]()

