Cho 7,9g hỗn hợp kim loại kiềm R và kim loại kiềm thổ M tác dụng với nước sinh ra 3,36 lít khí h2 (đktc) Tìm R
Mọi người giúp em với ạ .cám ơn nhiều ạ.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Ta có n H 2 = P V R T = 1 . 6 , 11 22 , 4 273 ( 273 + 25 ) = 0 , 25 m o l
Gọi A là kí hiệu, nguyên tử khối của kim loại.
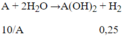
⇒10/A= 0,24 →A = 40 (Ca)

Đáp án B
Phương trình phản ứng
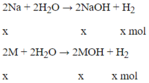
Theo đề bài ta có: 23x +Mx = 6,2 (1)
Áp dụng định luật bảo toàn khối lượng ta có:
mkim loại + mnước = mdd + mhiđro
Từ đó: mhiđro = mkim loại - mnước = mdd = 6,2 + 104 - 110 = 0,2 (g)
⇒x = 0,1 mol, thay vào (1) ta được M = 39 (K)

1.1. Al + NaOH + H2O ==> NaAlO2 + 3/2H2
nH2(1)=3,36/22,4=0.15(mol)
=> nAl(1)= nH2(1):3/2= 0.15:3/2= 0.1(mol)
2.Mg + 2HCl ==> MgCl2 + H2
3.2Al + 6HCl ==> 2AlCl3 + 3H2
4.Fe + 2HCl ==> FeCl2 + H2
=> \(n_{H_2\left(2,3,4\right)}=\) 10.08/22.4= 0.45(mol)
=> nH2(3)=0.1*3/2=0.15(mol)
MgCl2 + 2NaOH ==> Mg(OH)2 + 2NaCl
AlCl3 + 3NaOH ==> Al(OH)3 + 3NaCl
FeCl2 + 2NaOH ==> Fe(OH)2 + 2NaCl

\(n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\) \(n_{H_2SO_4}=0,3.0,25=0,075\left(mol\right)\)
\(X+H_2SO_{4\left(l\right)}\rightarrow XSO_4+H_2\uparrow\)
0,06 0,06 0,06 0,06 (mol)
dư:0 0,015 0 0 (mol)
b/
m\(M_X=\dfrac{3,36}{0,06}=56\left(g\right)\)
\(\rightarrow Fe\)
c/
\(2Fe+6H_2SO_{4\left(đn\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
0,06 0,09 (mol)
V\(_{SO_2}=0,09.22,4=2,016\left(l\right)\)

\(Mg\left(x\right)+2HCl\rightarrow MgCl_2+H_2\left(x\right)\)
\(2Al\left(y\right)+6HCl\rightarrow2AlCl_3+3H_2\left(1,5y\right)\)
\(Fe\left(z\right)+2HCl\rightarrow FeCl_2+H_2\left(z\right)\)
\(Mg\left(x\right)+Cl_2\left(x\right)\rightarrow MgCl_2\)
\(2Al\left(y\right)+3Cl_2\left(1,5y\right)\rightarrow2AlCl_3\)
\(2Fe\left(z\right)+3Cl_2\left(1,5z\right)\rightarrow2FeCl_3\)
Gọi số mol của Mg, Al, Fe trong hỗn hợp lần lược là x, y, z ta có
\(24x+27y+56z=26,05\left(1\right)\)
Số mol H2: \(\frac{13,44}{22,4}=0,6\)
\(\Rightarrow x+1,5y+z=0,6\left(2\right)\)
Số mol Cl2 là: \(\frac{17,36}{22,4}=0,775\)
\(\Rightarrow x+1,5y+1,5z=0,775\left(3\right)\)
Từ (1), (2), (3) ta có hệ: \(\left\{\begin{matrix}24x+27y+56z=26,05\\x+1,5y+z=0,6\\x+1,5y+1,5z=0,775\end{matrix}\right.\)
M ra đáp số âm không biết có phải do đề sai không

a. 2Al + 3H2SO4 ------> Al2(SO4)3 + 3H2
x 3/2x
Fe + H2SO4 -------> FeSO4 + H2
y y
b. Ta có :
n H2 ( đktc) = 0,56/22,4 = 0,025 mol
Ta có Pt : 27x + 56y = 0,83
3/2x + y = 0,025
=> x = 0.01 mol
y = 0.01 mol
=> m Al = 0,01 . 27 = 0,27g
m Fe = 0,01 . 56 = 0,56g
=> %m Al = 0,27/0,83 .100% = 32,5%
%m Fe = 100% - 32.5% = 67.5%

Chia làm hai phần bằng nhau mỗi phần co 8,9g hỗn hợp.
Phần 1:
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
x x x
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
y y y
\(\left\{{}\begin{matrix}24x+65y=8,9\\x+y=0,15\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=\dfrac{17}{820}\\y=\dfrac{53}{410}\end{matrix}\right.\)
\(\Rightarrow n_{H_2SO_4}=\dfrac{17}{820}+\dfrac{53}{410}=0,15mol\)
\(a=C_{M_{H_2SO_4}}=\dfrac{0,15}{0,2}=0,75M\)
\(m_{Mg}=2\cdot\dfrac{17}{820}\cdot24=1g\)
\(\Rightarrow m_{Zn}=17,8-1=16,8g\)