Hòa tan hoàn toàn 10g hỗn hợp X gồm Mg và Fe bằng dung dịch HCl 2M. Kết thúc thí nghiệm thu được dung dịch Y và 5,6l khí H2 (đktc). Để kết tủa hoàn toàn các cation có trong Y cần vừa đủ 300ml NaOH 2M. Xác định thể tích dung dịch HCl ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Gọi a, b và c lần lượt là số mol của Mg, Fe3O4 và Fe(NO3)2.
Hỗn hợp khí Y gồm NO (0,07 mol) và H2 (0,03 mol).
Cho 8,66 gam X tác dụng với dung dịch hỗn hợp HCl và HNO3 thì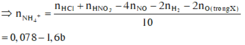
Cho Y tác dụng với NaOH, lọc kết tủa đun nóng thu được 10,4 gam hỗn hợp rắn gồm MgO (a mol) và Fe2O3 (1,5b + 0,5c) mol. Từ dữ kiện đề bài ta có hệ sau
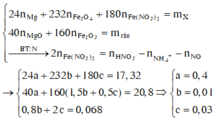

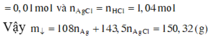

Đặt \(\left\{{}\begin{matrix}n_{Mg}=n_{MgCl_2}=a\left(mol\right)\\n_{Fe}=n_{FeCl_2}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+56b=5,12\) (1)
Ta có: \(n_{H_2}=\dfrac{2,688}{22,4}=0,12\left(mol\right)\)
Bảo toàn electron: \(2a+2b=0,24\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=n_{MgCl_2}=0,05\left(mol\right)\\b=n_{FeCl_2}=0,07\left(mol\right)\end{matrix}\right.\)
Bảo toàn nguyên tố: \(n_{HCl\left(p/ứ\right)}=2n_{MgCl_2}+2n_{FeCl_2}=0,24\left(mol\right)\)
PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Theo PTHH: \(n_{HCl\left(dư\right)}=n_{NaOH}=0,06\left(mol\right)\)
\(\Rightarrow\Sigma n_{HCl}=0,3\left(mol\right)\) \(\Rightarrow m_{ddHCl}=\dfrac{0,3\cdot36,5}{36,5\%}=30\left(g\right)\)
Mặt khác: \(m_{H_2}=0,12\cdot2=0,24\left(g\right)\)
\(\Rightarrow m_{dd}=m_{KL}+m_{ddHCl}-m_{H_2}=34,88\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeCl_2}=\dfrac{0,07\cdot127}{34,88}\cdot100\%\approx25,49\%\\C\%_{MgCl_2}=\dfrac{0,05\cdot95}{34,88}\cdot100\%\approx13,62\%\\C\%_{HCl\left(dư\right)}=\dfrac{0,04\cdot36,5}{34,88}\cdot100\%\approx4,19\%\end{matrix}\right.\)

Gọi \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow24a+56b=20\) (1)
Bảo toàn nguyên tố: \(n_{HCl}=2n_{MgCl_2}+2n_{FeCl_2}=2n_{Mg}+2n_{Fe}=2a+2b\)
\(\Rightarrow2a+2b=0,5\cdot2\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,25\\b=0,25\end{matrix}\right.\)
+) Trong không khí
Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe}=0,125\left(mol\right)\\n_{MgO}=n_{Mg}=0,25\left(mol\right)\end{matrix}\right.\) \(\Rightarrow m_1=0,125\cdot160+0,25\cdot40=30\left(g\right)\)
+) Trong chân không
Bảo toàn nguyên tố: \(n_{FeO}=n_{Fe}=n_{Mg}=n_{MgO}=0,25\left(mol\right)\)
\(\Rightarrow m_2=0,25\cdot72+0,25\cdot40=28\left(g\right)\)

Chọn D.
Gọi a, b và c lần lượt là số mol của Mg, Fe3O4 và Fe(NO3)2.
Cho 8,66 gam X tác dụng với dung dịch hỗn hợp HCl và HNO3 thì :
+ Hỗn hợp khí Y gồm NO (0,035 mol) và H2 (0,015 mol).
+ Xét dung dịch Y ta có:

Cho Y tác dụng với NaOH, lọc kết tủa đun nóng thu được 10,4 gam hỗn hợp rắn gồm MgO (a mol) và Fe2O3 (1,5b + 0,5c) mol. Từ dữ kiện đề bài ta có hệ sau:
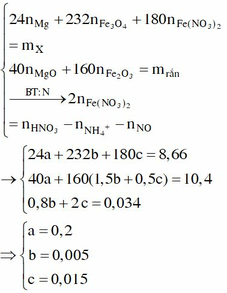
Þ n=0,035 mol Khi cho dung dịch Y tác dụng với lượng dư dung dịch với AgNO3 thì:
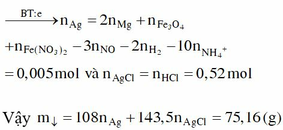

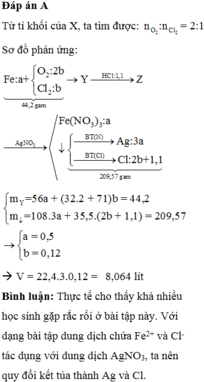
Đáp án A
Sơ đồ:
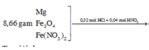
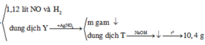
Ta giải được: ![]()
Do có sinh ra khí H2 nên dung dịch Y coi như đã hết NO 3 - .
Gọi a, b, c lần lượt là số mol 3 chất trong X
![]()
T tác dụng với NaOH lọc kết tủa rồi nung thu được 10,4 gam rắn gồm MgO và Fe2O3.
![]()
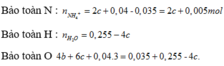
Giải hệ :a=0,2 ;b=0,005; c=0,015.
Kết tủa khi cho AgNO3 vào gồm AgCl 0,52 mol và Ag
Bảo toàn e:
![]()
→ m = 75,16 gam