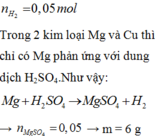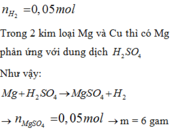Hòa Tan Hoàn Toàn 21,4 (gam) h2 Mg(OH)2 và Cu(OH)2 bằng 200g dd H2SO x% vừa đủ , sau Phản ứng thu được 40 (g) muối
a) Tìm x
b) Tìm C% Mỗi muối trong phản ứng
Giúp em với ạ :<
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
Gọi n_{Mg(OH)_2} = a(mol) ; n_{Ca(OH)_2} = b(mol)$
\(Mg\left(OH\right)_2+H_2SO_4\text{→}MgSO_4+H_2O\)
a a a (mol)
\(Ca\left(OH\right)_2+H_2SO_4\text{→}CaSO_4+H_2O\)
b b b (mol)
Ta có :
$58a + 74b = 21,4$
$120a + 136b = 40$
Suy ra a = 0,05 ; b = 0,25
$n_{H_2SO_4} = a + b = 0,3(mol)$
$x\% = \dfrac{0,3.98}{200}.100\% = 14,7\%$
c)
$m_{dd} = 21,4 + 200 - 0,25.136 = 187,4(gam)$
$C\%_{MgSO_4} = \dfrac{0,05.120}{187,4}.100\% = 3,2\%$

a) Chất rắn không tan là Cu
=> m Cu = 19,2(gam)
n Mg = a(mol) ; n Fe = b(mol)
=> 24a + 56b = 32,8 -19,2 = 13,6(1)
$Mg + H_2SO_4 \to MgSO_4 + H_2$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
n H2 = a + b = 6,72/22,4 = 0,3(2)
Từ (1)(2) suy ra a = 0,1 ; b = 0,2
%m Cu = 19,2/32,8 .100% = 58,54%
%m Mg = 0,1.24/32,8 .100% = 7,32%
%m Fe = 100% -58,54% -7,32% = 34,14%
b)
m dd A = 32,8 + 200 - 0,3.2 = 232,2(gam)
n MgSO4 = a = 0,1(mol)
n FeSO4 = b = 0,2(mol)
C% MgSO4 = 0,1.120/232,2 .100% = 5,17%
C% FeSO4 = 0,2.152/232,2 .100% = 13,09%

Bài 1 :
Số mol của nhôm
nAl = \(\dfrac{m_{Al}}{M_{Al}}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Pt : 2Al + 3H2SO4 → Al2(SO4)3 + 3H2\(|\)
2 3 1 3
0,2 0,3 0,3
a) Số mol của dung dịch axit sunfuric
nH2SO4 = \(\dfrac{0,2.3}{2}=0,3\left(mol\right)\)
Thể tích của dung dịch axit sunfuric
CMH2SO4 = \(\dfrac{n}{V}\Rightarrow V=\dfrac{n}{C_M}=\dfrac{0,3}{0,2}=1,5\left(l\right)\)
b) Số mol của khí hidro
nH2 = \(\dfrac{0,3.3}{3}=0,3\left(mol\right)\)
Thể tích của khí hidro ở dktc
VH2 = nH2 . 22,4
= 0,3. 22,4
= 6,72 (l)
Chúc bạn học tốt
2. Để hòa tan hoàn toàn m(g) kẽm cần vừa đủ 100(g) dung dịch H2SO4 4,9% .
a) Tìm m?
b) Tìm V lít khí thoát ra ở đktc?
c) Tính C% của muối thu được sau sau phản ứng?
---
a) mH2SO4=4,9%.100=4,9(g) -> nH2SO4=4,9/98=0,05(mol)
PTHH: Zn + H2SO4 -> ZnSO4 + H2
Ta có: nZn=nZnSO4=nH2=nH2SO4=0,05(mol)
m=mZn=0,05.65=3,25(g)
b) V(H2,đktc)=0,05.22,4=1,12(l)
c) mZnSO4=0,05. 161=8,05(g)
mddZnSO4=mZn + mddH2SO4 - mH2= 3,25+100 - 0,05.2=103,15(g)
=> C%ddZnSO4= (8,05/103,15).100=7,804%

Đáp án D
n H 2 = 0 , 05 m o l
Trong 2 kim loại Mg và Cu thì chỉ có Mg phản ứng với dung dịch H2SO4
Như vậy: ![]()
![]()

Theo giả thiết ta có: \(n_{HCl}=0,144\left(mol\right);n_{H_2SO_4}=0,054\left(mol\right)\)
\(\Rightarrow n_{H^+}=0,252\left(mol\right)\)
\(OH^-+H^+\rightarrow H_2O\)
\(\Rightarrow n_{H_2O}=0,252\left(mol\right)\)
Bảo toàn khối lượng ta có:
\(m=8,748+0,144.36,5+0,054.98-0,252.18=14,76\left(g\right)\)