trình bày phương pháp thực nghiệm để xác định nồng độ % và nồng độ mol của một mẫu thử dung dịch CuSO4
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


* Phương pháp xác định nồng độ phần trăm dung dịch C u S O 4
- Cân một lượng dung dịch C u S O 4 xác định.
- Cô cạn dung dịch cho đến khi thu được chất rắn màu trắng đó là C u S O 4 . Sau đó đem cân lượng muối sau khi cô cạn này ta được số liệu là mct.
- Áp dụng công thức: 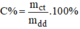 ta sẽ tính C% của dung dịch
C
u
S
O
4
.
ta sẽ tính C% của dung dịch
C
u
S
O
4
.
* Phương pháp xác định nồng độ mol của dung dịch C u S O 4 :
- Đong 1 thể tích dung dịch C u S O 4 xác định, đem cân lượng dung dịch đó.
- Sau đó dùng công thức 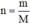 để tính số mol của
C
u
S
O
4
.
để tính số mol của
C
u
S
O
4
.
- Tính nồng độ mol của dung dịch
C
u
S
O
4
bằng công thức: 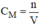

Refer.
Phương pháp xác định nồng độ phần trăm của dung dịch CuSO4 .
– Cân lấy một lượng dung dịch CuSO4 tuỳ ý, ví dụ 100 g.
– Cô cạn dung dịch cho đến khi thu được chất rắn màu trắng là CuSO4.
– Cân muối CuSO4 thu được sau khi cô cạn, thí dụ được 8 g.
– Tính nồng độ phần trăm của dung dịch CuSO4 ban đầu :
\(C\%=\dfrac{8}{100}\cdot100\%=8\%\)
Phương pháp xác định nồng độ mol của dung dịch CuSO4 :
– Cân lấy một lượng dung dịch CuSO4 tuỳ ý rồi đo thể tích. Thí dụ, cân lấy 100 g dung dịch CuSO4 như trong thí nghiệm trên, đo thể tích được 90 ml.
– Tính số mol CuSO4 có trong 90 ml (hoặc 100 g) dung dịch là :
\(n_{CuSO_4}=\dfrac{8}{160}=0.05\left(mol\right)\)
– Tính nồng độ mol của dung dịch CuSO4 :
\(C_M=\dfrac{1000\cdot0.05}{90}=0.56\left(M\right)\)

\(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có : \(n_{NaOH}=n_{HCl}\Leftrightarrow C_{MNaOH}.V_{NaOH}=C_{MHCl}.V_{HCl}\)
\(\Rightarrow C_{MNaOH}=\dfrac{C_{MHCl}.V_{HCl}}{V_{NaOH}}=\dfrac{0,1.0,01}{0,0102}\simeq0,1l=100ml\)

Bài 1: Bạn tự học nhé
Bài 2:
\(C_M=\dfrac{n}{V}=\dfrac{2,5}{4}=0,625M\)
Bài 3:
\(a,CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\\ b,SO_3+H_2O\rightarrow H_2SO_4\)
Bài 4:
a, HNO3 - axit nitric
Ca(OH)2 - canxi hiđroxit
b, K2SO4
NaHCO3
mình làm nốt bài 1 :)))
oxit là 1 hợp chất trong đó có 1 hay nhiều nguyên tử Oxi liên kết với 1 đơn chất
VD : CO2 , FeO

a) Fe + CuSO4 --> FeSO4 + Cu
b) \(m_{ddCuSO_4}=100.1,12=112\left(g\right)\)
=> \(m_{CuSO_4}=\dfrac{112.10}{100}=11,2\left(g\right)\)
=> \(n_{CuSO_4}=\dfrac{11,2}{160}=0,07\left(mol\right)\)
\(n_{Fe}=\dfrac{1,96}{56}=0,035\left(mol\right)\)
PTHH: Fe + CuSO4 --> FeSO4 + Cu
____0,035->0,035----->0,035
=> \(\left\{{}\begin{matrix}C_{M\left(CuSO_4\right)}=\dfrac{0,07-0,035}{0,1}=0,35M\\C_{M\left(FeSO_4\right)}=\dfrac{0,035}{0,1}=0,35M\end{matrix}\right.\)

\(a.Fe+CuSO_4\rightarrow FeSO_4+Cu\\ b.n_{Cu}=\dfrac{3,2}{64}=0,05mol\\ n_{CuSO_4}=\dfrac{100.1,12.10}{100}:160=0,7mol\\ \Rightarrow\dfrac{0,05}{1}< \dfrac{0,07}{1}\Rightarrow CuSO_4.dư\\ Fe+CuSO_4\rightarrow FeSO_4+Cu\)
0,05 0,05 0,05 0,05 (mol)
\(C_M\) \(_{FeSO_4}=\dfrac{0,05}{0,1}=0,5M\)
\(C_M\) \(_{CuSO_4}=\dfrac{0,07-0,05}{0,1}=0,2M\)

- Nhỏ vài giọt dung dịch phenolphtalein vào cả ba dung dịch. Dung dịch nào có màu hồng là dung dịch KOH.
- Lấy các thể tích bằng nhau của ba dung dịch : V ml dung dịch KOH và V ml của mỗi dung dịch axit. Thêm vào hai dung dịch axit vài giọt dung dịch phenolphtalein. Đổ V ml dung dịch KOH vào từng V ml dung dịch axit, sau đó thêm một ít dung dịch KOH nữa, nếu có màu hồng thì dung dịch axit đó là H N O 3 , ngược lại nếu không có màu hồng là dung dịch H 2 S O 4 .

trình bày phương pháp thực nghiệm để xác định nồng độ % và nồng độ mol của một mẫu thử dung dịch CuSO4
Trả lời
a) Phương pháp xác định nồng độ phần trăm của dung dịch CuSO4 .
– Cân lấy một lượng dung dịch CuSO4 tuỳ ý, ví dụ 100 g.
– Cô cạn dung dịch cho đến khi thu được chất rắn màu trắng là CuSO4.
– Cân muối CuSO4 thu được sau khi cô cạn, thí dụ được 8 g.
– Tính nồng độ phần trăm của dung dịch CuSO4 ban đầu :
C%=100%×8100=8%C%=100%×8100=8%
b) Phương pháp xác định nồng độ mol của dung dịch CuSO4 :
– Cân lấy một lượng dung dịch CuSO4 tuỳ ý rồi đo thể tích. Thí dụ, cân lấy 100 g dung dịch CuSO4 như trong thí nghiệm trên, đo thể tích được 90 ml.
– Tính số mol CuSO4 có trong 90 ml (hoặc 100 g) dung dịch là :
nCuSO4=8160=0,05(mol)nCuSO4=8160=0,05(mol)
– Tính nồng độ mol của dung dịch CuSO4 :
CM=1000×0,0590≈0,56(mol/l)
a) Phương pháp xác định nồng độ phần trăm của dung dịch CuSO4 .
– Cân lấy một lượng dung dịch CuSO4 tuỳ ý, ví dụ 100 g.
– Cô cạn dung dịch cho đến khi thu được chất rắn màu trắng là CuSO4.
– Cân muối CuSO4 thu được sau khi cô cạn, thí dụ được 8 g.
– Tính nồng độ phần trăm của dung dịch CuSO4 ban đầu :
C% = (100%×8):100=8%
b) Phương pháp xác định nồng độ mol của dung dịch CuSO4 :
– Cân lấy một lượng dung dịch CuSO4 tuỳ ý rồi đo thể tích. Thí dụ, cân lấy 100 g dung dịch CuSO4 như trong thí nghiệm trên, đo thể tích được 90 ml.
– Tính số mol CuSO4 có trong 90 ml (hoặc 100 g) dung dịch là :
\(_{n_{CuSO4}}\) = 8:160=0,05(mol)
– Tính nồng độ mol của dung dịch CuSO4 :
\(_{C_M}\)= (1000×0,05) : 90 ≈ 0,56(mol/l)