Bài 1: Hoàn thành các PTHH sau:
1. Al+HNO3−−−>NO+..............
2. Al+HNO3−−−>NO2+.............
3. Al+HNO3−−−>N2O+..............
4. Al+HNO3−−−>NH3+.............
(Sau dấu ... có thể có nhiều chất khác nhau)
Bài 2: Cho 11g hỗn hợp Al và Fe phản ứng vừa đủ 500ml dd HCl.xM. Sau phản ứng người ta thấy thoát ra 8,96l H2. Tính x và %khối lượng mỗi kim loại trong hỗn hợp
Bài 3: Cho 25g hỗn hợp Fe và Zn hòa tan trong 800 ml dd HCl.0.95M. Tính thể tích khí H2 thoát ra


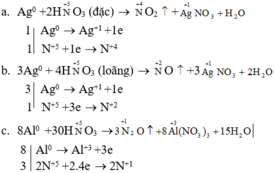
nH2 = 0,4 mol
Đặt nAl = x (mol); nFe = y (mol); ( x, y > 0 )
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2 (1)
x........3x...........................1,5x
Fe + 2HCl \(\rightarrow\) FeCl2 + H2 (2)
y........2y........................y
Từ (1)(2) ta có hệ pt
\(\left\{{}\begin{matrix}27x+56y=11\\1,5x+y=0,4\end{matrix}\right.\)
\(\Rightarrow\) \(\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(\Rightarrow\) %Al = \(\dfrac{0,2.27.100}{11}\) \(\approx\) 49,1%
\(\Rightarrow\) %Fe = \(\dfrac{0,1.56.100}{11}\) \(\approx\) 50,9%
\(\Rightarrow\) nHCl = ( 3.0,2 ) + ( 0,1. 2 ) = 0,8 (mol)
\(\Rightarrow\) x = \(\dfrac{0,8}{0,5}\) = 1,6 (M)
Bài 1
1) Al + 4HNO3 -> NO + 2H2O +Al(NO3)3
2) Al + 4HNO3 -> NO2 + H2O + Al(NO3)3
3) 8Al + 30HNO3 -> 3N2O + 15H2O + 8Al(NO3)3
4) 8Al + 27HNO3 -> 8NH3 + 9H2O + 8Al(NO3)3