A là hỗn hợp gồm: Ba,Al,Mg.
-Lấy m gam A cho tác dụng với nước tới khi hết phản ứng thấy thoát ra 3,36 lít H2 (đktc)
-Lấy m gam A cho vào dung dịch xút dư tới khi hết phản ứng thấy thoát ra 6,72 lít H2 (đktc)
-Lấy m gam A hòa tan bằng một lượng vừa đủ dd HCl thì thu được dd và 12,32 lít H2 (đktc)
Hãy tính m gam và thần phần % theo khối lượng của mỗi kim loại trong hỗn hợp

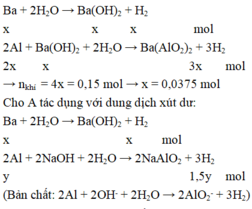




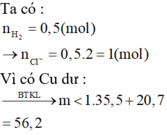
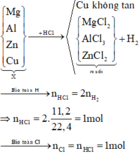
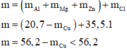
TN1:Cho A t/d với H2O
Ba+ H2O -------> Ba(OH)2+ H2 (1)
a........a......................a.............a
Ba(OH)2+ 2Al + 2H2O-------> Ba(AlO2)2+ 3H2(2)
a................2a........2a.......................a..............3a
TN2:Cho A t/d với xút dư (NaOH) => Al hết
Ba+ 2H2O -----> Ba(OH)2+ H2(3)
a........2a...................a.............a
NaOH+ Al+ H2O ------> NaAlO2+ 3/2H2(4)
b...........b.......b.....................b............1.5b
TN3:Cho A t/d với HCl vừa đủ
Ba+ 2HCl -------> BaCl2+ H2(5)
a........2a...................a.........a
2Al+ 6HCl --------> 2AlCl3+ 3H2(6)
b..........3b.....................b.........1.5b
Mg+ 2HCl ---------> MgCl2+ H2(7)
c..........2c.......................c..........c
(Khi Al t/d với dd kiềm hoặc kiềm thổ thì nH2=3/2nAl
Nếu TN1 và TN2 Al p/ư vừa đủ thì VH2 ở 2 pt phải bằng nhau
Mà VH2(TN1)<VH2(TN2)=> Al ở TN1 dư=> tính theo Ba(OH)2
nH2(TN1)=0.15 mol
nH2(TN2)=0.3 mol
nH2(TN3)=0.55 mol
Đặt a, b, c là số mol Ba, Al, Mg
Khi đó theo pt(1)& (2) =>nH2=a+3a=0.15mol=>a=0.0375 (I)
Theo pt(3), (4) nH2=a+1.5b=0.3 (II)
Theo pt(5), (6), (7) nH2=a+1.5b+c=0.55 (III)
Giải hệ pt (I), (II), (III) =>a=0.0375 mol, b=0.175 mol, c=0.25 mol
=> m= 0.0375*137+0.175*27+0.25*24=15.8625 g
Do đó
%mBa=(0.0375*137*100)/15.8625=32.39%
%mAl=(0.175*27*100)/15.8625=29.79%
%mMg=37.82%