Tính nồng độ mol của các ion trong dung dịch thu được khi hòa tan 1,74 gam K2SO4 vào nước được 400ml dung dịch
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(a,C_{M\left(NaOH\right)}=\dfrac{0,3}{0,5}=0,6M\\ b,n_{NaOH}=\dfrac{24}{40}=0,6\left(mol\right)\\ C_{M\left(NaOH\right)}=\dfrac{0,6}{0,4}=1,5M\)

a, \(\left[Ca^{2+}\right]=\dfrac{0,15.0,5}{0,15+0,05}=0,375M\)
\(\left[Na^+\right]=\dfrac{0,05.2}{0,15+0,05}=0,5M\)
\(\left[Cl^-\right]=\dfrac{0,15.2.0,5+0,05.2}{0,15+0,05}=1,25M\)

\(n_{Na_2O}=\dfrac{12,4}{62}=0,2\left(mol\right)\\ Na_2O+H_2O\rightarrow2NaOH\\ n_{NaOH}=0,2.2=0,4\left(mol\right)\\ C_{MddNaOH}=\dfrac{0,4}{0,4}=1\left(M\right)\)

$n_{BaCl_2} = \dfrac{41,6}{208} = 0,2(mol)$
$C_{M_{BaCl_2}} = 0,2 : 0,5 = 0,4M$
$BaCl_2 \to Ba^{2+} + 2Cl^-$
$[Ba^{2+}] = 0,4M ; [Cl^-] = 0,4.2 = 0,8M$

\(n_{Na_2CO_3}=\dfrac{2,12}{106}=0,02\left(mol\right)\\ C_{MddNa_2CO_3}=\dfrac{0,02}{2}=0,01\left(M\right)\)
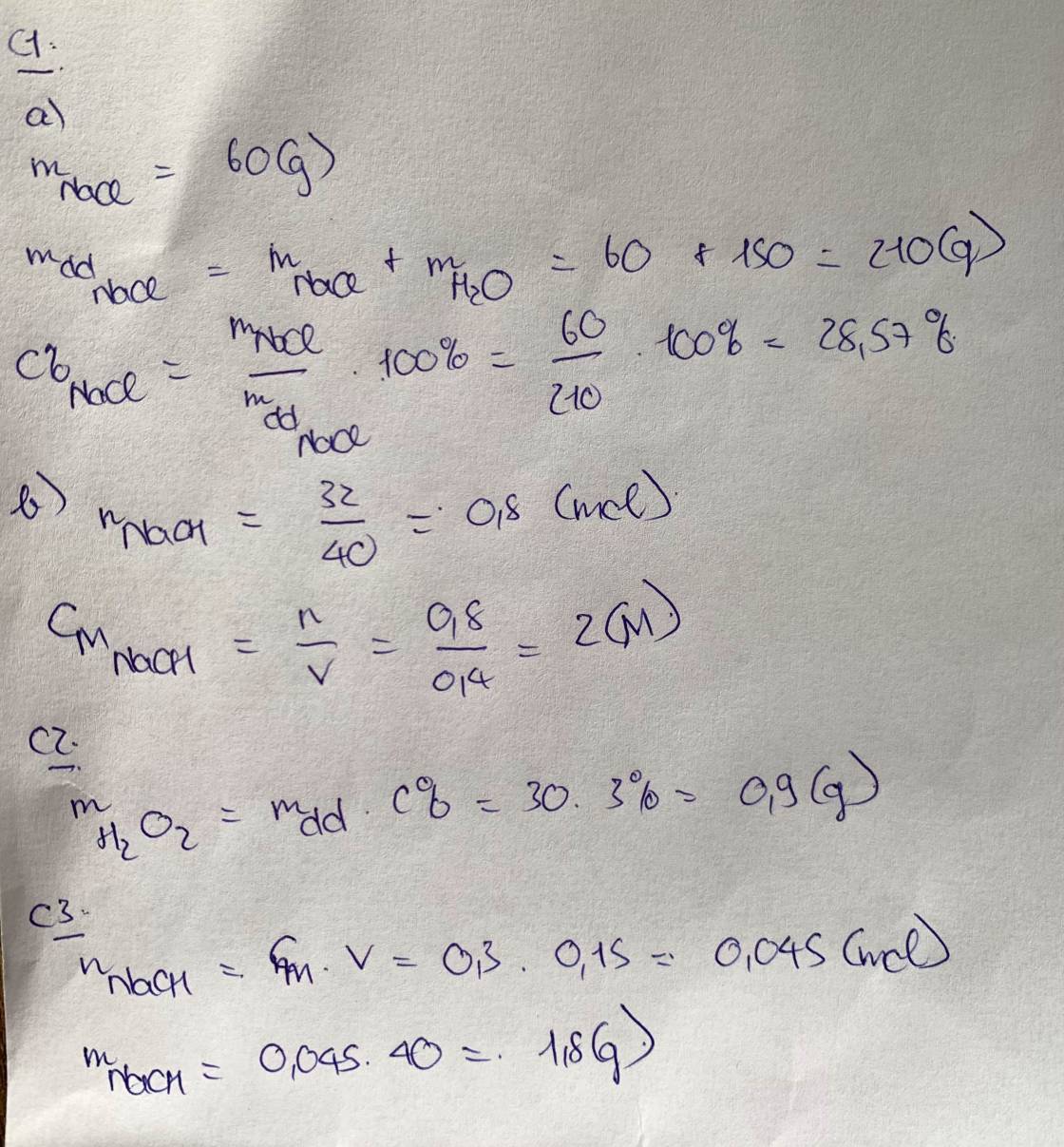
\(n_{K_2SO_4}=\dfrac{1,74}{174}=0,01\left(mol\right)\)
\(\Rightarrow C_{M\left(K_2SO_4\right)}=\dfrac{0,01}{0,4}=0,025M\)
Phương trình điện li: \(K_2SO_4\rightarrow2K^++SO_4^{2-}\)
\(\Rightarrow\left[K^+\right]=2C_{M\left(K_2SO_4\right)}=0,05M\)
\(\left[SO_4^{2+}\right]=C_{M\left(K_2SO_4\right)}=0,025M\)