Bài 3: Khi phân tích một mẫu quặng bôxit (chứa Al,O,), người ta thấy có 5,4 g nhôm. Tính xem trong mẫu quặng đó có bao nhiêu gam nhôm oxit Al,O, ứng với lượng nhôm trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2Al2O3--->4Al+3O2
ta có
cứ 204 tấn Al2O3_____108 tấn Al
--> 4 tấn AL cần 7,56 tấn Al2O3
vì hàm lượng quặng chỉ chứa 40% nên lượng quặng ban đầu là 18,9 tấn
H=90%
-->khối lượng quặng cần là 21 tấn

Theo ĐLBTKL: mAl2O3 = mAl + mO2
=> mAl2O3 = 10,8 + 9,6 = 20,4 (g)
=> \(\%Al_2O_3=\dfrac{20,4}{21,2}.100\%=96,226\%\)

Lượng nhôm oxit có trong 0,5 tấn quặng là : 0,5x50/100 = 0,25 tấn = 250kg
Phương trình hoá học điều chế Al :
2 Al 2 O 3 → 4Al + 3 O 2
Khối lượng Al nguyên chất thu được từ 250 kg quặng :
x = 250x4x27/(2x102) = 132,4(kg)
Khối lượng Al lẫn tạp chất: 132,4 x 101,5% = 134,386 (kg).

\(PTHH:2Al_2O_3\rightarrow4Al+3O_2\)
Cứ \(204\)tấn\(Al_2O_3\)tham gia pứ thì thu được \(108\) tấn \(Al\)
\(\Rightarrow\)Để thu được \(5,4\) tấn \(Al\) cần \(10,2\)tấn \(Al_2O_3\)
Vì: \(H=75\%\Rightarrow m_{Al_2O_3}=\frac{10,2.100}{75}=13,6\)(Tấn)
Mà quặng chỉ chứa\(80\%Al_2O_3\)
\(\Rightarrow\) Khối lượng quặng để điều chế\(5,4\)tấn \(Al\) là:
\(m_{quặng}=\frac{13,6.100}{80}=17\)(Tấn)
Vậy ......

a/ nAl= 54/27= 2(mol)
nO2=48/32=1,5(mol)
PTHH: 2 Al2O3 -to-> 4 Al +3 O2
Ta có: 2/4 = 1,5/3
=> P.ứ hết
=> nAl2O3= 1/2. nAl=1/2. 2=1(mol)
=> mAl2O3=1.102=102(g)
b) %mAl2O3= (102/127,5).100= 80%

chị vào chỗ này là sẽ có đáp án đấy:Câu hỏi của Đào Minh Anh - Hóa học lớp 8

Phương trình hóa học:
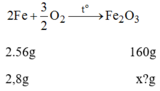
Khối lượng F e 2 O 3 ứng với lượng sắt trên là:
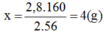
→ Chọn C.
\(Al_2O_3\\ n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ \Rightarrow n_O=\dfrac{3}{2}.0,2=0,3\left(mol\right)\\ m_{Al_2O_3}=0,2.27+0,3.16=10,2\left(g\right)\)
3/2 ở đâu ạ