hỗn hợp b gồm các kim loại k, ba ,cu. hòa tan 3,18g hỗn hợp b vao nước dư sau khi phản ứng hoàn toàn thu đc dung dịch c vsf m(g) chât srawns d cô đọng dung dịch c thu đc 3,39 ham chât rắn màu trắng đem chất rắn d nung trong không khí đến m khoong đổi tì đc chất rắn e có khối lượng ( m+0,16 ) g. tính thành phần phần trăm khối lượng của mỗi kim loại trong hỗn hợp b
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

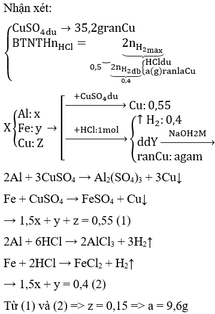
Chất rắn D là Cu, chất rắn E là CuO
\(m_{tăng}=m_{O_2}=0,16\left(g\right)\)
=> \(n_{O_2}=\dfrac{0,16}{32}=0,005\left(mol\right)\)
PTHH: 2Cu + O2 --to--> 2CuO
0,01<-0,005
=> mCu = 0,01.64 = 0,64 (g)
Gọi số mol K, Ba là a, b (mol)
=> 39a + 137b = 3,18 - 0,64 = 2,54 (1)
PTHH: 2K + 2H2O --> 2KOH + H2
a--------------->a
Ba + 2H2O --> Ba(OH)2 + H2
b--------------->b
=> 56a + 171b = 3,39 (2)
(1)(2) => a = 0,03 (mol); b = 0,01 (mol)
=> \(\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{0,64}{3,18}.100\%=20,126\%\\\%m_K=\dfrac{0,03.,39}{3,18}.100\%=36,792\%\\\%m_{Ba}=\dfrac{0,01.137}{3,18}.100\%=43,082\%\end{matrix}\right.\)
\(m_{O_2}=m+0,16-m=0,16\left(g\right)\\ \rightarrow n_{O_2}=\dfrac{0,16}{32}=0,005\left(mol\right)\)
PTHH: 2Cu + O2 --to--> 2CuO
0,01 0,005
Gọi \(\left\{{}\begin{matrix}n_K=a\left(mol\right)\\n_{Ba}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
2K + 2H2O ---> 2KOH + H2
a a
Ba + 2H2O ---> Ba(OH)2 + H2
b b
Hệ pt \(\left\{{}\begin{matrix}39a+137b=3,18-0,01.64=2,54\\56a+171b=3,39\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,03\left(mol\right)\\b=0,01\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{0,01.64}{3,18}=20,13\%\\\%m_K=\dfrac{0,03.39}{3,18}=36,79\%\\\%m_{Ba}=100\%-20,13\%-36,79\%=43,08\%\end{matrix}\right.\)

Hòa tan 3,18 gam hỗn hợp B vào nước dư thì chỉ có K, Ba tan hết còn Cu không tan.
PTHH:
2K + 2H2O —> 2KOH + H2
Ba + 2H2O —> Ba(OH)2 + H2
- Dung dịch C là: KOH, Ba(OH)2
- Chất rắn D là: Cu.
- Cô cạn dung dịch C thu được 3,39 gam.
=> mKOH + mBa(OH)2 = 3,39 gam.
- Đem D nung nóng trong không khí có:
PTHH : 2Cu + O2 —> 2CuO
mol 0,01 <— 0,005
Theo đề bài, ta có:
mCuO= m+0, 16 (gam)
=> mO2= 0,16 gam
=> nO2= m/M= 0,16/32= 0,005 mol.
Theo PTHH, ta có:
nCu= 2nO2= 2× 0,005=0, 01 mol.
=> mCu= n. M=0, 01.64= 0,64 gam.
=> m(K+Ba) =3,18-0, 64=2, 54 gam.
Đặt nK=x(mol), nBa= y(mol)
=> 39x+137y=2, 54(gam) (1)
Theo PTHH, ta có:
nKOH=nK=x(mol)
nBa(OH)2 = nBa=y(mol)
=> 56x+171y= 3,39 gam (2)
Từ (1), (2)
=> x= 0,03 hay nK=0, 03 mol
=> y= 0,01 hay nBa= 0,01 mol
=> % mK= 0,03.39/3, 18.100%
= 36,68%
% mBa= 0,01.137/3,18 . 100%
= 43,08%
=> % mCu = 100 -43, 08-36, 68
= 20,24%

Đáp án D
(a) Hỗn hợp Fe3O4 và Cu (tỉ lệ mol 1:1) có thể tan hết trong dung dịch HCl dư.
(c) Hỗn hợp Na và Al2O3 (có tỉ lệ mol 2:1) có thể tan hoàn toàn trong nước.
(e) Hỗn hợp kim loại Cu và Ag có thể tan hoàn toàn trong dung dịch gồm KNO3 và H2SO4 loãng.
(g) Kim loại cứng nhất là W, kim loại có nhiệt độ nóng chảy thấp nhất là Hg.

nH2 = 2,352 = 0,098 (mol)
mH2 = 0,098 . 2 = 0,196 (g)
PTHH:
Mg + 2HCl -> MgCl2 + H2
2Al + 6HCl -> 2AlCl3 + 3H2
Fe + 2HCl -> FeCl2 + H2
Từ PTHH: nHCl = 2.nH2 = 2 . 0,098 = 0,196 (mol)
mHCl = 0,196 . 36,5 = 7,154 (g)
Áp dụng ĐLBTKL, ta có:
mkl + mHCl = mmuối + mH2
=> mmuối = 3,53 + 7,154 - 0,196 = 10,448 (g)

Dung dịch A: dd KOH
Rắn B: Cu, Fe
Khí C: H2
Các PTHH:
\(2K+2H_2O\rightarrow2KOH+H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\)