1.
a) Tính phần trăm the khối lượng mỗi nguyên tố có trong hợp chất Fe2(SO4)3
b) Một hợp chất có gồm 3 nguyên tố là Cu, S và O trong đố Cu và S lần lượt chiếm 40% và 20% về khối lượng còn lại là oxi. Biết rằng trong một phân tử hợp chất có 4 nguyên tử O. Hãy xác định công thức hóa học của hợp chất trên

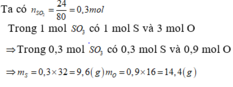

a, %m\(_{Fe}\) = \(\frac{56\cdot2\cdot100\%}{56\cdot2+\left(32+16\cdot4\right)\cdot3}\)= 28(%)
%m\(_S\) = \(\frac{32\cdot3\cdot100\%}{56\cdot2+\left(32+16\cdot4\right)\cdot3}\)= 24(%)
%m\(_O\) = \(\frac{16\cdot4\cdot3\cdot100\%}{56\cdot2+\left(32+16\cdot4\right)\cdot3}\) = 48(%)
b, %m\(_O\) = 100% - 20% - 40% = 40(%)
Mà trong hợp chất có 4 nguyên tử Oxi
\(\Rightarrow\) M\(_{hợp}chất\) = \(\frac{40\cdot4\cdot100}{100}\) = 160 (g/mol)
\(\Rightarrow\) m\(_S\) = \(\frac{20\cdot160}{100}\)= 32 (gam )
\(\Rightarrow\) n\(_S\) = 32/32 = 1 (mol)
m\(_{Cu}\)= \(\frac{40\cdot160}{100}\) = 64 (gam)
\(\Rightarrow\) n\(_{Cu}\)= 64/64 = 1 (mol)
Vậy công thức hóa học của hợp chất trên là CuSO\(_4\)