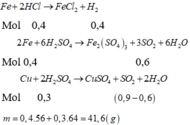Cho m g hỗn hợp Fe,Cu vào dung dịchH2SO4 đặc nóng thu đc 3,08 l khí SO2 đkc và dd A . Cũng lượng Fe, Cu trên nhưng cho vào dung dịch HCL dư thì Chỉ thu được 1,68l khí đkc a/ tính % m Fe ;b/ dẫn khí SO2 thu ở trên vào 100ml dd Ba(OH )2 1,2 M . Tính m muối tạo thành
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a/ \(n_{SO_2}=\dfrac{3,08}{22,4}=0,1375\left(mol\right);n_{H_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)
2Fe + 6H2SO4(đ) ---to---> Fe2(SO4)3 + 6SO2 + 3H2O
x 3x
Cu + 2H2SO4(đ) ---to---> CuSO4 + SO2 + 2H2O
y y
Fe + 2HCl ----> FeCl2 + H2
x x
Cu + 2HCl -----> CuCl2 + H2
y y
Ta có hệ pt: \(\left\{{}\begin{matrix}3x+y=0,1375\\x+y=0,075\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,03125\left(mol\right)\\y=0,04375\left(mol\right)\end{matrix}\right.\)
\(m_{hh}=0,03125.56+0,04375.64=4,55\left(g\right)\)
\(\%m_{Fe}=\dfrac{0,03125.56.100\%}{4,55}=38,46\%\)
b, \(n_{Ba\left(OH\right)_2}=0,1.1,2=0,12\left(mol\right)\)
Ta có: \(T=\dfrac{n_{SO_2}}{n_{Ba\left(OH\right)_2}}=\dfrac{0,1375}{0,12}=1,1458\)
=> tạo ra 2 muối là BaSO3 và Ba(HSO3)2
SO2 + Ba(OH)2 ---> BaSO3 + H2O
x x x
2SO2 + Ba(OH)2 ----> Ba(HSO3)2
y 0,5y 0,5y
Ta có hệ pt: \(\left\{{}\begin{matrix}x+y=0,1375\\x+0,5y=0,12\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1025\left(mol\right)\\y=0,035\left(mol\right)\end{matrix}\right.\)
\(m_{muối}=0,1025.217+0,5.0,035.299=27,475\left(g\right)\)

nFe= a mol
n FeO= b mol
Ta có 56a+72b=18,8 (1)
2Fe+ 6H2SO4(đ)-> Fe2(SO4)3 +3SO2+6H2O
a. 1,5a
2FeO +4H2SO4(đ)-> Fe2(SO4)3 +SO2+4H2O
b. 0,5b
Mặt khác ta có
Fe+H2SO4(l)-> FeSO4+H2
a. a
FeO+H2SO4-> FeSO4+H2O
a=nH2=1,12/22,4=0,05
Từ (1)=>b=0,222mol
=> nSO2=1,5a+0,5b= 0,186mol
V(SO2)=4,1664LIT
B, %mFe= 0,05.56.100%/18,8=14,9%
mFeO= 18,8-,05.56=16g
=> %mFeO = 16.100%/18,8=85,1%

nH2=4,48/22,4=0,2 mol
Fe +2HCl -->FeCl2+H2
0,2 0,2 mol
=>mFe=0,2*56=11,2 g
nSO2=10,08/22,4=0,45 mol
gọi số mol của Cu là a mol
bảo toàn e ta có
Cu\(^0\)-->Cu\(^{+2}\)+2e
a 2a S\(^{+6}\) + 2e -->S\(^{+4}\)
Fe\(^0\)--> Fe\(^{+3}\)+3e 0,45 0,9
0,2 0,6
=>a=0,15=>mCu=0,15*64=9,6 g
=>mhh=9,6+11,2=20,8g
=>%Cu=9,6*100/20,8=46,15%

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right);n_{SO_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
0,2------------------------>0,2
\(2Fe+6H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
0,2---------------------------------------->0,3
\(Cu+2H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}CuSO_4+SO_2+2H_2O\)
0,15<--------------------------------0,15
=> \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2.56}{0,2.56+0,15.64}.100\%=53,85\%\\\%m_{Cu}=100\%-53,85\%=46,15\%\end{matrix}\right.\)