Hỗn hợp X gồm 2 kim loại Mg và R.
TN1: Cho 8g hỗn hợp X vào dung dịch HCl dư thu được 4,48 l ở đktc.
TN2: Cho 16g hỗn hợp X tác dụng với dung dịch H2SO4 đặc nóng dư thu được 1 khí Z (sản phẩm khử duy nhất) không màu, mùi hắc. Khí Z này được hấp thụ hoàn toàn cvào 450 ml dung dịch KOH 2M thu được 75,2 g muối kali. Xác định R.



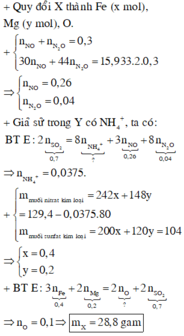
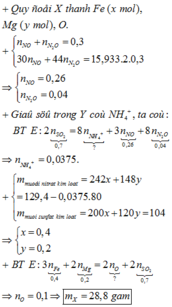

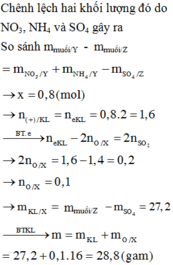
Xét thí nghiệm 2: Khí Z sinh ra từ phản ứng của H2SO4 đặc nóng, có mùi hắc, không màu -> là khí SO2
Khí SO2 phản ứng với KOH tạo ra 2 muối KHSO3 và K2SO3
SO2 + KOH -> KHSO3
SO2 + 2KOH -> K2SO3 + H2O
Đặt số mol KOH ở 2 phương trình lần lượt là a, b
theo phương trình và khối lượng muối thu được ta có hệ phương trình sau:
(1) a + 2b= 0,45*2 mol
(2) (39+1+32+16*3) + (39*2+32+16*3) = 75,2 gam
Giải phương trình (1), (2) -> a=0,1; b= 0,4
theo phương trình -> số mol SO2 = 0,1 + 0,4:2= 0,3 mol
Xét thí nghiệm 1:
Kim loại phản ứng với HCL thu được số mol H2= 4,48:22,4= 0,2 mol
Ở thí nghiệm 2 toàn bộ khí SO2 thu được là do cả 2 kim loại đều phản ứng với axit đặc nóng; -> Với khối lượng 8g như thí nghiệm 1 thì số mol SO2 thu được = 0,3:2= 0,15 mol
Mg hóa trị 2 nên khi phản ứng với HCL hay axit đặc nóng đều sinh ra khí với tỉ lệ mol 1:1. Nhận thấy với khối lượng như nhau nhưng số mol khí thu được khác nhau -> kim loại R có nhiều hóa trị. ( Xét trường hợp hóa trị kim loại R là II và III)
Mg +2HCL-> MgCl2+ H2 (3)
R +2HCl -> RCl2 + H2 (4)
Mg + h2so4-> MgSO4 + SO2 + H2O (5)
2R+4h2so4 -> R2(SO4)3 + SO2 + 4h2o (6)
Đặt số mol Mg= x, số mol R= y
từ các phương trình 3,4,5,6 ta có hệ
x+y=0,2
x + 0,5y= 0,15
Giải hệ trên được x= 0,1; y=0,1
-> mR= 8 - 0,1*24= 5,6 gam
-> MR= 5,6 : 0,1 = 56 (Fe)
Vậy R là kim loại Sắt