Cho 5,6 gam iron Fe tác dụng với dung dịch sulfuric acid H2SO4 dư sinh ra V lít chất khí (ở đkc). Giá trị của V là: (biết Fe=56) *
1 điểm
2,24
22,4
2,479
24,79
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Mol: 0,1 0,1
\(m_{Fe_2\left(SO_4\right)_3}=0,1.400=40\left(g\right)\)

Đáp án D
Bảo toàn electron có: 3. n F e = 3. n N O → n F e = n N O = 0,1mol.
Vkhí = 0,1.22,4 = 2,24 lít.

Đáp án B
Xét giai đoạn m gam Fe tác dụng với dung dịch H2SO4 loãng:
Sơ đồ phản ứng :
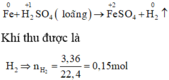
Các quá trình nhường, nhận electron :
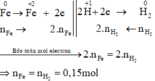
Xét giai đoạn m gam Fe tác dụng với H2SO4 đặc, nóng , dư:
Sơ đồ phản ứng:
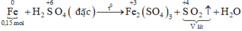
Các quá trình nhường, nhận electron:
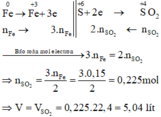

\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: 0,1 0,1 0,1 0,1
\(V_{H_2}=0,1.24,79=2,479\left(l\right)\)
\(C_{M_{ddH_2SO_4}}=\dfrac{0,1}{0,2}=0,5M\)
\(C_{M_{ddFeSO_4}}=\dfrac{0,1}{0,2}=0,5M\)
A nha 2,24