Câu 1: Ở 20°C, khi hòa tan 60 gam KNO3 vào 190g nước thì thu được dùng dịch bão hòa. Tính độ tan của KNO3 ở nhiệt độ đó?
Câu 2: Đốt cháy hoàn toàn 25.2 sắt trong bình chứa khí O2. A: Hãy t viết chương trình phản ứng xảy ra
B: Tính thể tích khí O2 ( ở đktc) đã tham gia phản ứng trên.
C: Tính khối lượng KCLO3 cần dùng để khi thu được một thể tích khí O2 (đktc) bằng thể tích khí O2 đã sử dụng ở phản ứng trên?
M.n giải giúp mk vs ak

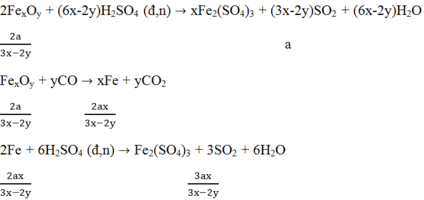
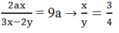

C1: Độ tan của KNO3 ở 20oC là:
S KNO3= 60/190*100= 31.57g
C2:
nFe= 25.2/56=0.45 mol
3Fe + 2O2 -to-> Fe3O4
0.45___0.3
VO2= 0.3*22.4=6.72l
2KClO3 -to-> 2KCl + 3O2
0.2________________0.3
mKClO3= 0.2*122.5=24.5g
Câu 1:
\(S^{20^0C}_{KNO_3}=\frac{60}{190}.100=31,57\left(g\right)\)
Câu 2:
a) \(3Fe+2O_2\underrightarrow{t^0}Fe_3O_4\left(1\right)\)
b) \(n_{Fe}=\frac{25,2}{56}=0,45\left(mol\right)\)
Theo PTHH (1): \(n_{Fe}:n_{O_2}=3:2\)
\(\Rightarrow n_{O_2}=n_{Fe}.\frac{2}{3}=0,45.\frac{2}{3}=0,3\left(mol\right)\)
\(\Rightarrow V_{O_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\)
c) PTHH: \(2KClO_3\underrightarrow{t^0}2KCl+3O_2\left(2\right)\)
Theo PTHH (2): \(n_{O_2}:n_{KClO_3}=3:2\)
\(\Rightarrow n_{KClO_3}=n_{O_2}.\frac{2}{3}=0,3.\frac{2}{3}=0,2\left(mol\right)\)
\(\Rightarrow m_{KClO_3}=0,2.122,5=24,5\left(g\right)\)