Lập công thức đơn giản của các oxit có thành phần về khối lượng như sau:
a) 40% S còn lại là oxi
b) mCu:mO=4:1
c) Cứ 7g Fe kết hợp với 3g O
d) Có 1 phần khối lượng là H và 8 phần khối lượng là O
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1: Thành phần phần trăm về khối lượng của nguyên tố Fe trong hợp chất Fe3O4 là:
A. 72,4%
B. 68,8%
C. 76%
D. 62,5%
Câu 2: Hợp chất X có khối lượng mol phân tử là 232 g/mol, thành phần phần trăm khối lượng của Fe là 72,41%, còn lại là của O. Công thức hóa học của X là
A. Fe3O4.
B. FeO.
C. Fe3O2.
D. Fe2O3.
Câu 3: Trong 1 mol phân tử FeCl3 có bao nhiêu gam nguyên tử clo?
A. 71,0 gam.
B. 35,5 gam.
C. 142,0 gam
D. 106,5 gam.
Câu 4: Có bao nhiêu mol nguyên tử O trong 1 mol phân tử N2O5?
A. 2 mol.
B. 4 mol.
C. 5 mol.
D. 3 mol.
Câu 5: Khối lượng của Fe trong 92,8 g Fe3O4 là
A. 25,6 g.
B. 67,2 g.
C. 80 g.
D. 10 g.

Giả sử khối lượng oxit là 10g ⇒ m F e = 7g ; m O = 3g
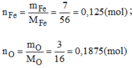
Vậy: 0,125 mol nguyên tử Fe kết hợp với 0,1875 mol nguyên tử O.
Suy ra 2 mol nguyên tử Fe kết hợp với 3 mol nguyên tử O (vì số nguyên tử luôn là số nguyên).
→ Công thức hóa học đơn giản của oxit sắt là: F e 2 O 3

Một loại đồng oxit có thành phần về khối lượng các nguyên tố như sau: 8 phần là đồng và 1 phần là oxi. Công thức đồng oxit trên là:
A. Cu2O B. CuO C. Cu2O3 D. CuO3.

\(m_{Fe}=\%Fe.M_X=28\%.400=112\left(g\right)\\ m_S=\%S.M_X=24\%.400=96\left(g\right)\\ m_O=m_X-m_{Fe}-m_S=400-112-96=192\left(g\right)\)
\(\Rightarrow n_{Fe}=\dfrac{m}{M}=\dfrac{112}{56}=2\left(mol\right)\)
\(m_S=\dfrac{m}{M}=\dfrac{96}{32}=3\left(mol\right)\)
\(m_O=\dfrac{m}{M}=\dfrac{192}{16}=12\left(mol\right)\)
\(CTHH:Fe_2\left(SO_4\right)_3\)

Gọi công thức chung là FexSyOz
%O2=48%
x:y:z=\(\dfrac{28}{56}:\dfrac{24}{32}:\dfrac{48}{16}=0,5:0,75:3=2:3:12\)
=> CTHH Fe2(SO4)3
tên: Sắt (III)sunfat

Bài 7:
Đặt CTHH là \(Ca_xN_yO_z\)
\(\%_O=100\%-24,4\%-17,1\%=58,5\%\\ x:y:z=\dfrac{24,4}{40}:\dfrac{17,1}{14}:\dfrac{58,5}{16}=0,61:1,22:3,66\approx1:2:6\\ \Rightarrow CTHH:Ca\left(NO_3\right)_2\)
Bài 8:
Đặt CTHH là \(C_xH_y\)
\(x:y=\dfrac{75}{12}:\dfrac{25}{1}=6,25:25=1:4\\ \Rightarrow CTHH:CH_4\)
a) 40% S còn lại là oxi
Ta có
m\(_S:m_O=40:60\)
=>n\(_S:n_O=\frac{40}{32}:\frac{60}{16}\)
=1,25:3,75
=1:3
CTHH:SO3
b) mCu:mO=4:1
=>n\(_{Cu}:n_O=\frac{4}{64}:\frac{1}{16}\)
=0,0625:0,0625
=1:1
CTHH:CuO
c) Cứ 7g Fe kết hợp với 3g O
m\(_{Fe}:m_O=7:3\)
=>n\(_{Fe}:n_O=\frac{7}{56}:\frac{3}{16}\)
=0,125:0,1875
=12:3
CTHH"Fe2O3
d) Có 1 phần khối lượng là H và 8 phần khối lượng là O
m\(_H:m_O=1:8\)
=>n\(_H:n_O=\frac{1}{1}:\frac{8}{16}=1:0,5\)
CTHH:H2O
Chúc bạn học tốt
a, \(n_S:n_O=\frac{40}{32}:\frac{60}{16}=1:3\)
CTHH : SO3
b,
\(n_{Cu}:n_O=\frac{4}{64}:\frac{1}{16}=1:1\)
=> CTHH : CuO
c,\(n_{Fe}:n_O=\frac{7}{56}:\frac{3}{16}=2:3\)
=>CTHH: Fe2O3
d,\(n_H:n_O=\frac{1}{1}:\frac{8}{16}=1:0,5\)
=>CTHH : H2O