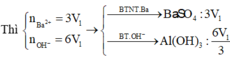
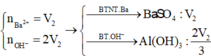
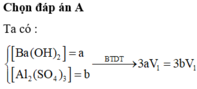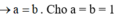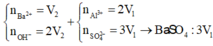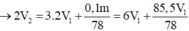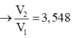Dung dịch X gồm Al2(SO4)3 0,75M và H2SO4 0,75M. Cho V1 ml dd KOH 1 M vào 100ml dd X thu được 3,9g kết tủa. Mặt khác cho V2 ml dd KOH 1M vào 100ml dd X cũng thu được 3,9g kết tủa. Biết các phản ứng xảy ra hoàn toàn. Tìm V2:V1
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



2)
\(\dfrac{2}{x-1}+\dfrac{4}{x+3}=3\\ ĐKXĐ:\left[{}\begin{matrix}x-1\ne0\\x+3\ne0\end{matrix}\right.\Leftrightarrow\left[{}\begin{matrix}x\ne1\\x\ne-3\end{matrix}\right.\)
\(\Leftrightarrow\dfrac{2\left(x+3\right)+4\left(x-1\right)}{\left(x-1\right)\left(x+3\right)}=\dfrac{3\left(x-1\right)\left(x+3\right)}{\left(x-1\right)\left(x+3\right)}\\ \Leftrightarrow2x+6+4x-4=3\left(x^2+2x-3\right)\\ \Leftrightarrow6x+2=3x^2+6x-9\\ \Leftrightarrow3x^2+6x-6x-9-2=0\\ \Leftrightarrow3x^2-11=0\\ \Leftrightarrow x=\pm\sqrt{\dfrac{11}{3}}\left(TMĐK\right)\)

Ta có: \(n_{NaOH}=0,2.1=0,2\left(mol\right)\)
\(n_{KOH}=0,2.1,5=0,3\left(mol\right)\)
\(\Rightarrow n_{OH^-}=n_{NaOH}+n_{KOH}=0,5\left(mol\right)\)
\(n_{HCl}=0,1.0,5=0,05\left(mol\right)=n_{H^+}\)
\(n_{AlCl_3}=0,1x\left(mol\right)=n_{Al^{3+}}\)
\(n_{Al\left(OH\right)_3}=\dfrac{3,9}{78}=0,05\left(mol\right)\)
TH1: Kết tủa chưa bị hòa tan
PT: \(H^++OH^-\rightarrow H_2O\)
_____0,05____0,05 (mol)
\(Al^{3+}+3OH^-\rightarrow Al\left(OH\right)_3\)
_________0,15_________0,05 (mol)
⇒ nOH- (pư) = 0,05 + 0,15 = 0,2 (mol) → OH- dư
⇒ Kết tủa phải bị hòa tan 1 phần.
→ Loại TH1.
TH2: Kết tủa đã bị hòa tan 1 phần.
PT: \(H^++OH^-\rightarrow H_2O\)
____0,05____0,05 (mol)
\(Al^{3+}+3OH^-\rightarrow Al\left(OH\right)_3\)
0,1x______0,3x________0,1x (mol)
\(Al\left(OH\right)_3+OH^-\rightarrow AlO_2^-+2H_2O\)
0,1x-0,05____0,1x-0,05 (mol)
⇒ 0,05 + 0,3x + 0,1x - 0,05 = 0,5 ⇒ x = 1,25 (M)

nBaSO4 = 0,18 mol
→nAl2(SO4)3 = 0,06
→V2 = 0,12 (l) → nAl3+=0,24 , nSO42-= 0,18 mol
nBa2+ = 0,5V1 mol
nOH- = 2V1 + 0,5V1 < 0,18
→ nOH- < 3nAl3+
→ Kết tủa tính theo Ba2+ và OH-
→ 56,916 = 233.0,5V1 + 78.2V1/3
→V1= 0,34 + 0,5V1 ≥ 0,18
→ nBaSO4 = 0,18 mol
→ nAl(OH)3 =0,192 mol
→ nOH- = 2V1 = 4nAl3+ − nkt = 0,768 mol
→ V1=0,384 (l)

\(n_{Al\left(OH\right)_3}=\dfrac{3,9}{78}=0,05mol\)
\(n_{NaOH}=0,2mol\)
\(n_{KOH}=0,2.1,5=0,3mol\)
\(\rightarrow n_{OH^-}=0,2+0,3=0,5mol\)
\(n_{H^+}=n_{HCl}=0,05mol\)
\(n_{Al^{3+}}=0,1xmol\)
H++OH-\(\rightarrow\)H2O
\(n_{OH^-\left(pu\right)}=n_{H^+}=0,05mol\)
\(n_{OH^-\left(dư\right)}=0,5-0,05=0,45mol\)
Al3++3OH-\(\rightarrow\)Al(OH)3(1)
Al(OH3+OH-\(\rightarrow\)AlO2-+H2O(2)
- Sau phản ứng (2) Al(OH)3 còn dư 0,05 mol
\(n_{OH^-\left(1\right)}=3n_{Al^{3+}}=0,3xmol\)
\(n_{Al\left(OH\right)_3\left(1\right)}=n_{Al^{3+}}=0,1xmol\)
\(n_{Al\left(OH\right)_3\left(2\right)}=0,1x-0,05\) mol
\(n_{OH^-\left(2\right)}=n_{Al\left(OH\right)_3\left(2\right)}=0,1x-0,05\)
Theo PTHH (1,2) ta có:
\(n_{OH^-}=n_{OH^-\left(1\right)}+n_{OH^-\left(2\right)}\)
\(\rightarrow\)0,45=0,3x+0,1x-0,05\(\rightarrow\)0,4x=0,5\(\rightarrow\)x=1,25M