1. Y là hỗn hợp gồm CO2 và SO2. Tỉ khối hơi của Y so với khí nitơ bằng 2
a) Tính phần trăm theo số mol mỗi khí trong Y.
b) Cho 0,112 lít (ở đktc) khí Y lội chậm qua 500 ml dung dịch Ba(OH)2 a M, để trung hòa vừa hết lượng bazơ còn dư trong dung dịch sau phản ứng cần dùng 25 ml dung dịch HCl 0,2 M. Các phản ứng xảy ra hoàn toàn. Tính a.
c) Bằng phương pháp hóa học, hãy chứng tỏ sự có mặt của các chất có trong hỗn hợp Y, viết phương trình phản ứng hóa học minh họa.
2. Hỗn hợp X gồm hai kim loại A và B có tỉ lệ khối lượng là 1:1. Trong đó 33,6 gam X này, số mol hai kim loại khác nhau 0,0375 mol. Biết hiệu MA - MB = 8 gam.
a) Xác định hai kim loại A, B.
b) Cho X lần lượt vào các dung dịch có chứa lượng dư các chất (riêng biệt): AgNO3; Fe(SO4)3. Viết các phương trình phản ứng hóa học đã xảy ra (theo đúng trình tự).

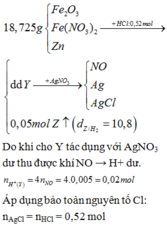





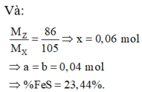
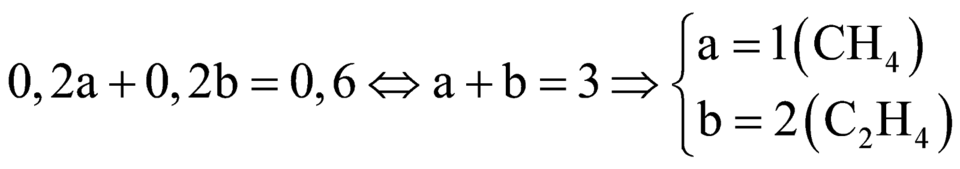

2.
Ta có: mA=mB=\(\frac{33,6}{2}\)=16,8
Vì MA >MB mà mA=mB \(\rightarrow\)nA<nB \(\rightarrow\) nB-nA=0,0375 mol
\(\rightarrow\) 16,8/MB-16,8/MA=0,0375
\(\rightarrow\)16,8/MB -16,8/(MB+8)=0,0375
\(\rightarrow\) MB=56 -> MA=64
\(\rightarrow\) A là Cu; B là Fe
Cho X vào lượng dư AgNO3
Cu + 2AgNO3\(\rightarrow\)Cu(NO3)2 + 2Ag
Fe + 3AgNO3\(\rightarrow\) Fe(NO3)3 +3Ag
Cho X vào lượng dư Fe2(SO4)3
Cu +Fe2(SO4)3 \(\rightarrow\)CuSO4 +2FeSO4
Fe +Fe2(SO4)3\(\rightarrow\) 3FeSO4
1.
a)
Giả sử nhh=1 mol
Gọi a là số mol CO2 b là số mol SO2
Mhh=28x2=56
Ta có\(\left\{{}\begin{matrix}\text{a+b=1}\\\text{44a+64b=56}\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}a=0,4\\b=0,6\end{matrix}\right.\)
%CO2=\(\frac{0,4}{1}.100\%\)=40%
%SO2=100-40=60%
b)
nhh=\(\frac{0,112}{22,4}\)=0,005 mol
\(\rightarrow\)nCO2=0,002 mol nSO2=0,003 mol
nHCl=0,2.0,025=0,005 mol
Ba(OH)2+CO2\(\rightarrow\)BaCO3+H2O
Ba(OH)2+SO2\(\rightarrow\)BaSO3+H2O
Ba(OH)2+2HCl\(\rightarrow\)BaCl2+2H2O
\(\rightarrow\)nBa(OH)2=0,0075 mol
a=\(\frac{0,0075}{0,5}\)=0,015
c)
Cho hh đi qua dd Br2 dd Br2 bị mất màu chứng tỏ có SO2
Cho hh đi qua dd Ca(OH)2 có kết tủa chứng tỏ có CO2
CO2+Ca(OH)2\(\rightarrow\)CaCO3+H2O
Br2+2H2O+SO2\(\rightarrow\)H2SO4+2HBr