Cho từ từ 500ml dung dịch NaOH 1,232M vào 200ml dung dịch(HCL 0,2M,ALCL3 0,8M). Sau phản ứng hoàn toàn thì thu được kết tủa đem nung kết tủa này đến khối lượng không đổi thì lượng chất rắn thu được là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
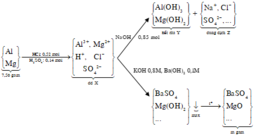
Xét NaOH +X
tạo 0,52 mol NaCl và 0,14 mol N a 2 S O 4 và dư 0,05 mol N a +
Ghép với A l O 2 - ⇒ tạo 0,05 mol N a A l O 2
Đặt n A l = x ; n M g = y
![]()
![]()
Giải hệ có: ![]()
![]()
TH1: B a S O 4 đạt cực đại
⇒ n B a ( O H ) 2 = n S O 4 = 0 , 14 m o l
⇒ n K O H = 0 , 14 . 8 = 1 , 12 m o l
Ghép tương tự NaOH, ta thấy B a 2 + , K + , S O 4 2 - , C l - còn dư 0,6 mol điện tích
Ghép với A l O 2 - ⇒ ghép được 0,15 mol
⇒ vẫn chưa đủ ⇒ còn O H - dư
Rắn gồm 0,14 mol B a S O 4 ; 0 , 15 m o l M g O ⇒ mrắn =38,62g
TH2: A l ( O H ) 3 đạt cực đại
⇒ các ion trong dung dịch gồm B a 2 + , K + , S O 4 2 - , C l -
(ta đang giả sử B a 2 + , S O 4 2 - cùng tồn tại trong cùng 1 dung dịch)
Đặt n B a 2 + = a ⇒ n K + = 8 a
Bảo toàn điện tích:
![]()
n B a S O 4 = n B a 2 + = 0 , 08 m o l
![]()
![]()
⇒ mrắn tối đa =38,62 (g)

Đáp án B
• ![]()
• Đặt số mol Mg, Al lần lượt là a, b => 24a + 27b = 7,65 g (1)
Có n NaOH = 0 , 85 > 0 , 52 + 2 . 0 , 14 = 0 , 8
=> Chứng tỏ Al(OH)3 bị hòa tan một phần: n AlO 2 - = 0 , 85 - 0 , 8 = 0 , 05 mol
⇒ m ↓ = m Mg ( OH ) 2 + m Al ( OH ) 3 = 58 a + 78 . ( b - 0 , 05 ) = 16 , 5 g (2)
• Từ (1) và (2) suy ra a = b = 0,15
• Đặt V (lít) là thể tích dung dịch kiềm thêm vào.
⇒ n B a 2 + = 0 , 1 V , n OH - = ( 0 , 8 + 2 . 0 , 1 ) V = V
P Lượng hiđroxit thu được cực đại khi: n OH - = n H + ⇒ V = 0 , 8 ( l )
Khi đó: n B a 2 + = 0 , 08 mol < n SO 4 2 - = 0 , 14 mol
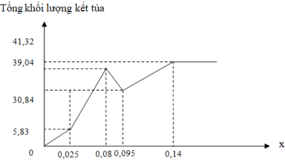
⇒ m ↓ = 58 . 0 , 15 + 78 . 0 , 15 + 233 . 0 , 08 = 39 , 04 g
P Lượng BaSO4 thu được cực đại khi: n Ba 2 + = n SO 2 - = 0 , 14 mol ⇒ n OH - = 1 , 4 mol
Khi đó: n OH - > n H + + n Al ⇒ Al ( OH ) 3 tan hết
⇒ m ↓ = 58 . 0 , 15 + 233 . 0 , 14 = 41 , 32 g > 39 , 04 g
=> Lượng kết tủa đạt cực đại khi V = 1,4 lít
⇒ m ↓ = m MgO + m B a S O 4 = 40 . 0 , 15 + 233 . 0 , 14 = 38 , 62 g
Gần nhất với giá trị 38,6

\(n_{AlCl_3}=0.2\cdot1=0.2\left(mol\right)\)
\(n_{NaOH}=0.5V\left(mol\right)\)
\(n_{Al_2O_3}=\dfrac{5.1}{102}=0.05\left(mol\right)\)
\(2Al\left(OH\right)_3\underrightarrow{^{^{t^0}}}Al_2O_3+3H_2O\)
\(0.1...............0.05\)
TH1 : Al(OH)3 không bị hòa tan.
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3+3NaCl\)
\(0.1...........0.3................0.1\)
\(\Leftrightarrow V=\dfrac{0.3}{0.5}=0.6\left(l\right)\)
TH2 : Al(OH)3 bị hòa tan một phần
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3+3NaCl\)
\(0.2...........0.6................0.2\)
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
\(0.5V-0.6...0.5V-0.6\)
\(n_{Al\left(OH\right)_3}=0.2+0.5V-0.6=0.1\left(mol\right)\)
\(\Rightarrow V=1\left(l\right)\)

Đáp án B
Hướng dẫn giải:
Ta có : nAlCl3= 0,15 mol ; nCuCl2= 0,1 mol ; nFeCl2= 0,15 mol
AlCl3+ 3NH3+ 3H2O → Al(OH)3+ 3NH4Cl
FeCl2+ 2NH3+ 2H2O → Fe(OH)2+ 2NH4Cl
CuCl2+ 4NH3 → [Cu(NH3)4]Cl2
Kết tủa A có Al(OH)3: 0,15 mol và Fe(OH)2: 0,15 mol
2Al(OH)3 → Al2O3+ 3H2O
2Fe(OH)2 +1/2 O2 → Fe2O3+2 H2O
Ta có m gam chất rắn chứa 0,075 mol Al2O3 và 0,075 mol Fe2O3
→ m= 0,075.102+ 0,075.160= 19,65 (gam)

Đáp án A
Khi thêm 0,85 mol NaOH vào X thì thu được dung dịch chứa NaCl: 0,52 mol và Na2SO4 : 0,14mol;
Vì n N a O H > n N a C l + 2 n N a 2 S O 4 nên còn N a A l O 2
Bảo toàn Na có n N a O H = n N a C l + 2 n N a 2 S O 4 + n N a A l O 2 → 0 , 85 = 0 , 52 + 2 . 0 , 14 + n N a A l O 2
→ n N a A l O 2 = 0,05 mol
Kết tủa thu được là M g ( O H ) 2 : x mol và A l ( O H ) 3 : y mol
Ta có hệ sau
→ dd X có A l + 3 : 0 , 15 m o l ; M g + 2 : 0 , 15 m o l ; C l - : 0 , 52 m o l ; S O 4 2 - : 0 , 14 m o l
Ta thấy X có 3 n A l + 2 n M g < n C l + 2 n S O 4 nên X có dư H + → n H + = 0,52 + 0,14.2 -0,15.3 -0,15.2 = 0,05 mol
OH- + H + → H2O
OH- + M g + 2 → M g ( O H ) 2
3OH- + A l + 3 → A l ( O H ) 3
B a 2 + + S O 4 2 - → B a S O 4
A l ( O H ) 3 + O H - → A l O 2 - + 2 H 2 O
Khi thêm 8x mol KOH và x mol B a ( O H ) 2 vào dung dịch X thì để thu được lượng kết tủa lớn nhất ta xét các TH sau
TH1 : kết tủa có B a S O 4 : 0,14 mol và M g ( O H ) 2 : 0,15 mol và có thể có A l ( O H ) 3
Bảo toàn Ba có x = 0,14 mol → n O H =8x + 2x =10x =1,4 mol > 2 n M g + 4 n A l + n H + = 0,95
→ phản ứng có kết tủa A l ( O H ) 3 bị hòa tan hết → kết tủa thu được là B a S O 4 và M g ( O H ) 2
→ đem nung thu được B a S O 4 : 0,14 mol và MgO : 0,15 mol → m = 38,62g
TH2: Kết tủa có A l ( O H ) 3 : 0,15 mol và Mg(OH)2: 0,15 mol; B a S O 4
Ta có n O H = 10x = 0,15.3 + 0,15.2 +0,05=0,8 → x = 0,08 mol→ có 0,08 mol B a S O 4
→ Đem nhiệt phân thu được 0,08 mol B a S O 4 ; 0,075 mol Al2O3 và 0,15mol MgO
→ m = 0,08.233 + 0,075.102 +0,15.40 =32,29g
Nên TH1 khối lượng kết tủa lớn nhất là 38,62 g gần nhất với 38,6 nhất


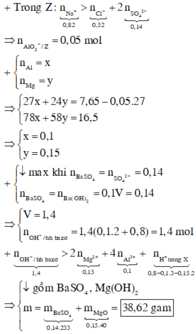



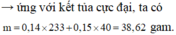


Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,5\cdot1,232=0,616\left(mol\right)\\n_{H^+}=0,2\cdot0,2=0,04\left(mol\right)\\n_{Al^{3+}}=0,2\cdot0,8=0,16\left(mol\right)\end{matrix}\right.\)
PT ion: \(H^++OH^-\rightarrow H_2O\)
0,04____0,04 (mol)
\(Al^{3+}+3OH^-\rightarrow Al\left(OH\right)_3\downarrow\)
0,16_____0,48________0,16 (mol)
\(Al\left(OH\right)_3+OH^-\rightarrow AlO_2+2H_2O\)
0,096____0,096 (mol)
\(\Rightarrow n_{Al\left(OH\right)_3\left(dư\right)}=0,16-0,096=0,064\left(mol\right)\)
Bảo toàn nguyên tố: \(n_{Al_2O_3}=\dfrac{1}{2}n_{Al\left(OH\right)_3}=0,032\left(mol\right)\)
\(\Rightarrow m_{Al_2O_3}=0,032\cdot102=3,264\left(mol\right)\)